


 微信在线咨询
微信在线咨询

| 产品编号 | 产品名称 | 产品包装 | 产品价格 |
| C3011-1ml | Ad-mCherry-GFP-LC3B | 1ml | 910.00元 |
| C3011-10ml | Ad-mCherry-GFP-LC3B | 10ml | 3740.00元 |
Ad-mCherry-GFP-LC3B,即adenovirus expressing mCherry-GFP-LC3B fusion protein,是一种可以表达mCherry-GFP-LC3B融合蛋白的腺病毒,可以用于感染细胞或组织后进行细胞自噬(autophagy)的检测。
LC3是酵母自噬关键蛋白ATG8在哺乳动物中的同源蛋白。LC3最初被分析鉴定为microtubule-associated protein 1 light chain 3 (MAP1LC3)。LC3蛋白家族包括LC3A、B、C和GABARAP等亚家族,其中对于LC3B的研究最为广泛。到目前为止,LC3B被认为是细胞自噬信号通路最为关键的标志性蛋白。LC3B是一个具有125个氨基酸残基的蛋白,在蛋白合成后,被Atg4所酶切而失去了C端的22个氨基酸蛋白,从而暴露出C端的甘氨酸,人们把它命名为胞质形式的LC3B I。在细胞自噬的过程中,其C端暴露的甘氨酸经过一个类似泛素化的过程,以ATG7为E1样激活酶(E1-like activating enzyme),以ATG3为E2样连接酶(E2-like conjugation enzyme),以Atg12-Atg5-Atg16复合物为E3样连接酶(E3-like ligase),在C端甘氨酸上共价连接上磷脂酰乙醇胺(phosphatidylethanolamine, PE)而成为LC3B-PE即LC3B II。与胞质定位的LC3B I不同,LC3B II定位于自噬体(autophagosome)的内膜和外膜上。在自噬体与溶酶体融合后,自噬体外膜上的LC3B II被Atg4所酶切,而自噬体内膜上的LC3B II则被溶酶体内的蛋白酶所降解。尽管LC3B II比LC3B I的分子量要大,但由于其极强的疏水性,在SDS-PAGE电泳时,LC3B II比LC3B I迁移得更快,其表观分子量分别为14kD和16kD。自噬(Autophagy)是一种在进化上高度保守的通过溶酶体吞噬并降解部分自身组分的细胞内分解代谢途径。自噬与多种生理功能有关,在饥饿等不利的环境条件下,细胞通过自噬降解多余或异常的细胞内组分,为细胞的生存提供能量及原材料,促进生物体的生长发育、细胞分化及对环境变化产生应答。自噬异常与多种病理过程如肿瘤、神经退行性疾病、代谢疾病、病原体感染等都有密切关系。由于细胞自噬在生理和病理过程中都有重要作用,自噬已经成为细胞生物学领域的一个新的研究热点。
Ad-mCherry-GFP-LC3B是碧云天自行研发的重组腺病毒,感染后能够在靶细胞中有效表达红色荧光蛋白mCherry、绿色荧光蛋白(GFP)和LC3B的融合蛋白,呈现明亮的红色和绿色荧光,可以用于细胞自噬的检测。
自噬小体在与溶酶体融合过程中,溶酶体内的酸性环境会导致GFP荧光淬灭,这为追踪GFP-LC3B的细胞定位增加了难度。mCherry是一种来自于蘑菇珊瑚(mushroom coral)的单体红色荧光蛋白,当其与GFP进行LC3B的共同标记时,在GFP被溶酶体酸性环境所淬灭的情况下,可以发出红色荧光的mCherry因为其卓越的稳定性而被保留。因此,通过融合表达mCherry-GFP-LC3B蛋白,可以非常有效地追踪自噬过程。在用Ad-mCherry-GFP-LC3B腺病毒感染细胞后,在非自噬的情况下,荧光显微镜下mCherry-GFP-LC3B以弥散的黄色荧光(mCherry和GFP的综合效果)形式存在于细胞质中;而在自噬的情况下,荧光显微镜下mCherry-GFP-LC3B则聚集在自噬体膜上,以黄色斑点的形式表现出来(LC3B dot or punctae);当自噬体与溶酶体融合后,因GFP荧光的部分淬灭而以红色斑点的形式表现出来。
腺病毒感染细胞后为瞬时表达,通常不会与基因组DNA重组,不能用于筛选稳定细胞株。本产品感染体内外细胞后,有效表达时间通常不少于7天,不同细胞和组织的有效表达时间有所不同。感染10-14天后融合蛋白的表达很可能会大大减弱。
碧云天的Ad-mCherry-GFP-LC3B采用了成熟的E1缺陷型重组腺病毒载体系统,感染普通的细胞后不能进行扩增和重组,从而可以有效降低本产品在活体生物中的风险。
本产品可以在表达E1的HEK293A、HEK293等适当细胞中扩增。
本产品的滴度≥1×108 pfu/ml,使用时可以按照108pfu/ml进行计算。如果按照20 MOI感染6孔板的细胞,每孔50万细胞计算,每毫升本产品共可以感染10个孔;如果按照20 MOI感染24孔板的细胞,每孔10万细胞计算,每毫升本产品共可以感染50个孔。如果MOI值提高,则相应可以感染的孔数会减少;如果MOI值降低,则相应可以感染的孔数会增加。
包装清单:
| 产品编号 | 产品名称 | 包装 |
| C3011-1ml | Ad-mCherry-GFP-LC3B | 1ml |
| C3011-10ml | Ad-mCherry-GFP-LC3B | 1ml×10 |
| - | 说明书 | 1份 |
保存条件:
-80℃保存,一年有效。-20℃保存,1-2个月内有效。4℃保存,一周内有效。
注意事项:
反复冻融会降低病毒滴度,如有必要请在收到本产品后分装保存。病毒融解后,如果在一周内使用,可以放置于4℃。如果-80℃保存时间超过一年,可能会导致滴度下降,此时建议重新测定病毒滴度。
腺病毒感染需要细胞表面的CAR受体,请确认拟使用的细胞或组织可以被腺病毒感染。
腺病毒对不同细胞的感染效率请参考下表。
| Species | Cell line | Origin | Transduction efficiency |
| Human | 293 | Embryonic Kidney | 95% |
| MCF-10A | Mammary epithelium | 51% | |
| MDA-MB-231 | Malignant breast cancer cell | 72% | |
| HepG2 | Hepatocarcinoma | 70% | |
| T24 | Transitional cell carcinoma | 37% | |
| TCCSUP | Transitional cell carcinoma | 53% | |
| PC-3 | Prostate cancer metastases site | 67% | |
| DU145 | Prostate cancer metastases site | 86% | |
| LNCaP | Prostate cancer metastases site | 69% | |
| Jurkat | T cell leukemia | 2% | |
| HRT | Rectal tumor | 5% | |
| Murine | MT1A2 | Mammary tumor transformed with SV40 T antigen | 92% |
| NIH 3T3 | Mouse fibroblast | 12% | |
| WEHI | Fibrosarcoma | 10% | |
| AML12 | Liver | 28% | |
| MS-K68 | Spleen | 48% | |
| EL4 | T cell | 2% | |
| Bovine | FBRT HE1 | Fetal retina transformed with Had5 E1 | 90% |
| MDBK | Kidney | 70% | |
| FBK-34 | Kidney transformed with BAd3 E1 | 25% | |
| BT-5705 | Turbinate | 28% | |
| EBL | Embryonic lung | 8% | |
| Porcine | FPRT HE1-5 | Fetal retina transformed with HAd5 E1 | 91% |
| PK-15 | Kidney | 76% | |
| PK-M12 | Kidney cell transformed with SV40 T antigen | 71% | |
| PT-K75 | Turbinate | 22% | |
| EPL | Embryonic lung | 53% | |
| SBC-1765 | Derived from buffy coat cells | 73% |
对于难感染的细胞,建议使用较高的MOI值(可以达到100、200或500MOI)同时使用促病毒感染试剂Polybrene (终浓度2~4μg/ml)以提高腺病毒的感染效率。
本产品使用前请仔细阅读附录1《腺病毒使用安全规范》。本产品生物安全等级为Biosafety Level 1 (BSL-1),没有确凿证据显示会导致健康成人产生疾病(Not known to consistently cause diseases in healthy adults),可以按照常规的微生物实验操作要求进行操作(Standard microbiological practices)。
本产品仅限于专业人员的科学研究用,不得用于临床诊断或治疗,不得用于食品或药品,不得存放于普通住宅内。
为了您的安全和健康,请穿实验服并戴一次性手套操作。
使用说明:
1. 感染条件的确定:
不同种类的细胞感染所需的MOI值是不同的,如果是初次使用腺病毒感染需要通过实验确定最佳的感染条件。
a.细胞培养(以6孔板NIH3T3细胞为例,其它培养板或培养皿参考6孔板进行操作):感染前一天在6孔板中以5×105/孔接种NIH3T3细胞,每孔加入2ml完全培养液(具体的接种数量由细胞大小和细胞生长速度而定),使第二天病毒感染时细胞密度达到约50%左右。
b.按照MOI 分别为2、5、10、20、40,计算所需病毒量,计算方法请参考附录2。
c.冰上解冻病毒,混匀后备用。
d.从细胞培养箱中取出6孔板,在显微镜下确定每孔的细胞均生长良好。吸弃旧培养液,每孔加入1.2ml新鲜培养液,并分别加入特定MOI值的病毒液,同时设置未加入病毒的细胞孔作为对照组。须特别注意在病毒感染时加入尽量少的新鲜培养液,以提升病毒的感染效率。对于培养液体积比较小的多孔板,例如96孔板和48孔板,也可以先把病毒用培养液稀释至所需的MOI值后再加入。
e.感染后约24h,除去含有病毒的培养液,每孔加入2ml新鲜的完全培养液,继续培养24h后观察细胞生长状况及荧光蛋白表达情况(参考图1),以不显著影响细胞生长、荧光较强且感染效率便于荧光观察的MOI值和感染后时间为最佳条件。
注1:检测细胞自噬时并非感染效率越高越好,通常约20-70%的感染效率已经足以进行自噬检测,感染效率过高反而容易产生细胞毒性而干扰检测。
注2:通常在腺病毒感染细胞后24小时即可观察到荧光蛋白表达的出现,在48小时左右有较强的表达效果。
注3:对于感染腺病毒后出现较强细胞毒性的情况,可以尝试在感染后6-12h更换成新鲜的完全培养液。
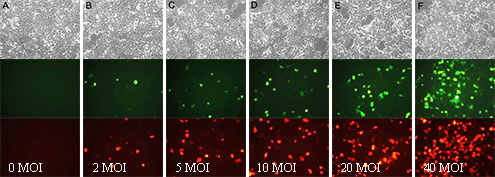
图1.Ad-mCherry-GFP-LC3B感染细胞的效果图。A、B、C、D、E和F依次为Ad-mCherry-GFP-LC3B分别在MOI值为0、2、5、10、20和40时感染NIH3T3细胞48h后的实拍效果图。上侧为明场照片,下侧为相同视野的荧光照片。
| BSL | Agents | Practices |
Primary Barriers and Safety Equipment |
Facilities (Secondary Barriers) |
| 1 | Not known to consistently cause diseases in healthy adults | Standard microbiological practices |
■ No primary barriers required. ■ PPE: laboratory coats and gloves; eye, face protection, as needed |
Laboratory bench and sink required |
| 2 |
■ Agents associated with human disease ■ Routes of transmission include percutaneous injury, ingestion, mucous membrane exposure |
BSL-1 practice plus: ■ Limited access ■ Biohazard warning signs ■ “Sharps” precautions ■ Biosafety manual defining any needed waste decontamination or medical surveillance policies |
Primary barriers: ■ BSCs or other physical containment devices used for all manipulations of agents that cause splashes or aerosols of infectious materials ■ PPE: Laboratory coats, gloves, face and eye protection, as needed |
BSL-1 plus: ■ Autoclave available |
| 3 | Indigenous or exotic agents that may cause serious or potentially lethal disease through the inhalation route of exposure |
BSL-2 practice plus: ■ Controlled access ■ Decontamination of all waste ■ Decontamination of laboratory clothing before laundering |
Primary barriers: ■ BSCs or other physical containment devices used for all open manipulations of agents ■ PPE: Protective laboratory clothing, gloves, face, eye and respiratory protection, as needed |
BSL-2 plus: ■ Physical separation from access corridors ■ Self-closing, double-door access ■ Exhausted air not recirculated ■ Negative airflow into laboratory ■ Entry through airlock or anteroom ■ Hand washing sink near laboratory exit |
| 4 |
■ Dangerous/exotic agents which post high individual risk of aerosol-transmitted laboratory infections that are frequently fatal, for which there are no vaccines or treatments ■ Agents with a close or identical antigenic relationship to an agent requiring BSL-4 until data are available to redesignate the level ■ Related agents with unknown risk of transmission |
BSL-3 practices plus: ■ Clothing change before entering ■ Shower on exit ■ All material decontaminated on exit from facility |
Primary barriers: ■ All procedures conducted in Class III BSCs or Class I or II BSCs in combination with full-body, air-supplied, positive pressure suit |
BSL-3 plus: ■ Separate building or isolated zone ■ Dedicated supply and exhaust, vacuum, and decontamination systems ■ Other requirements outlined in the text |
BSL, biosafety level; PPE, personal protective equipment.
相关产品:
| 产品编号 | 产品名称 | 包装 |
| C3006-1ml | Ad-GFP-LC3B | 1ml |
| C3006-10ml | Ad-GFP-LC3B | 10ml |
| C3011-1ml | Ad-mCherry-GFP-LC3B | 1ml |
| C3011-10ml | Ad-mCherry-GFP-LC3B | 10ml |
| C3012-1ml | AdPlus-mCherry-GFP-LC3B | 1ml |
| C3012-10ml | AdPlus-mCherry-GFP-LC3B | 10ml |









 微信在线咨询
微信在线咨询












