微信在线咨询
微信在线咨询

| 产品编号 | 产品名称 | 产品包装 | 产品价格 |
| PT516 | Rat TNF-α ELISA Kit | 96次 | 2798.00元 |
碧云天的Rat TNF-α ELISA Kit (Rat Tumor Necrosis Factor-α Enzyme-Linked ImmunoSorbent Assay Kit),即大鼠肿瘤坏死因子-α酶联免疫吸附检测试剂盒,是一种用于特异性地高灵敏地定量检测大鼠血清、血浆、细胞或组织裂解液、或细胞培养上清液中的TNF-α的试剂盒。
本产品检测灵敏度高,特异性强,重复性好。多次重复检测结果表明,最小检出量为26pg/ml,与GDNF、IL-1α、IL-1β、IL-2、IL-4、PDGF-BB、IL-10、人TNF-α、小鼠TNF-α等均没有交叉反应,板内、板间变异系数均小于10%。
TNF-α,即TNF、TNFα或TNFalpha,也称cachectin、cachexin或TNFSF1A。TNF-α由巨噬细胞、上皮细胞等多种细胞在细菌感染、内毒素刺激、病毒或寄生虫感染时产生。肿瘤坏死因子超家族(Tumor necrosis factor superfamily)共约19个成员,包含由巨噬细胞等产生的TNF-α和T淋巴细胞产生的TNF-β(也称Lymphotoxin-alpha),以及FASL、TRAIL、CD40L、CD27L、CD30L等。TNF-α与TNF-β在结构上有一定的相似性,并且在氨基酸水平有28%的同源性,它们拥有共同的受体TNFR1和TNFR2。由于TNF-α的生物学活性占TNF总活性的70%~95%,因此目前常说的TNF多指TNF-α。TNF (Tumor Necrosis Factor)因为能诱导细胞死亡而得名,实际上其很多时候诱导的细胞死亡为细胞凋亡。人TNF-α有两种形式,一种是由233个氨基酸组成的跨膜蛋白同源三聚体(homotrimers),另外一种是该跨膜蛋白在TNF-α转化酶TACE(TNF-α converting enzyme)的作用下切除信号肽,形成成熟的157个氨基酸的可溶性TNF-α单体(分子量为17KDa)的同源三聚体。无论TNF-α的跨膜同源三聚体还是可溶性同源三聚体(51kD),都具有生物学活性,但活性的差异目前仍有争议。小鼠和人的TNF-α有约79%的氨基酸同源性,也同样形成同源三聚体发挥作用。TNF-α可以诱导产生炎症反应、发烧(fever)、细胞凋亡、抑制肿瘤形成和病毒复制等。TNF-α也参与了包括哮喘、克罗恩氏病、类风湿性关节炎、神经性疼痛、阿兹海默症、肥胖症、II型糖尿病、自身免疫病和肿瘤等疾病的发生发展。
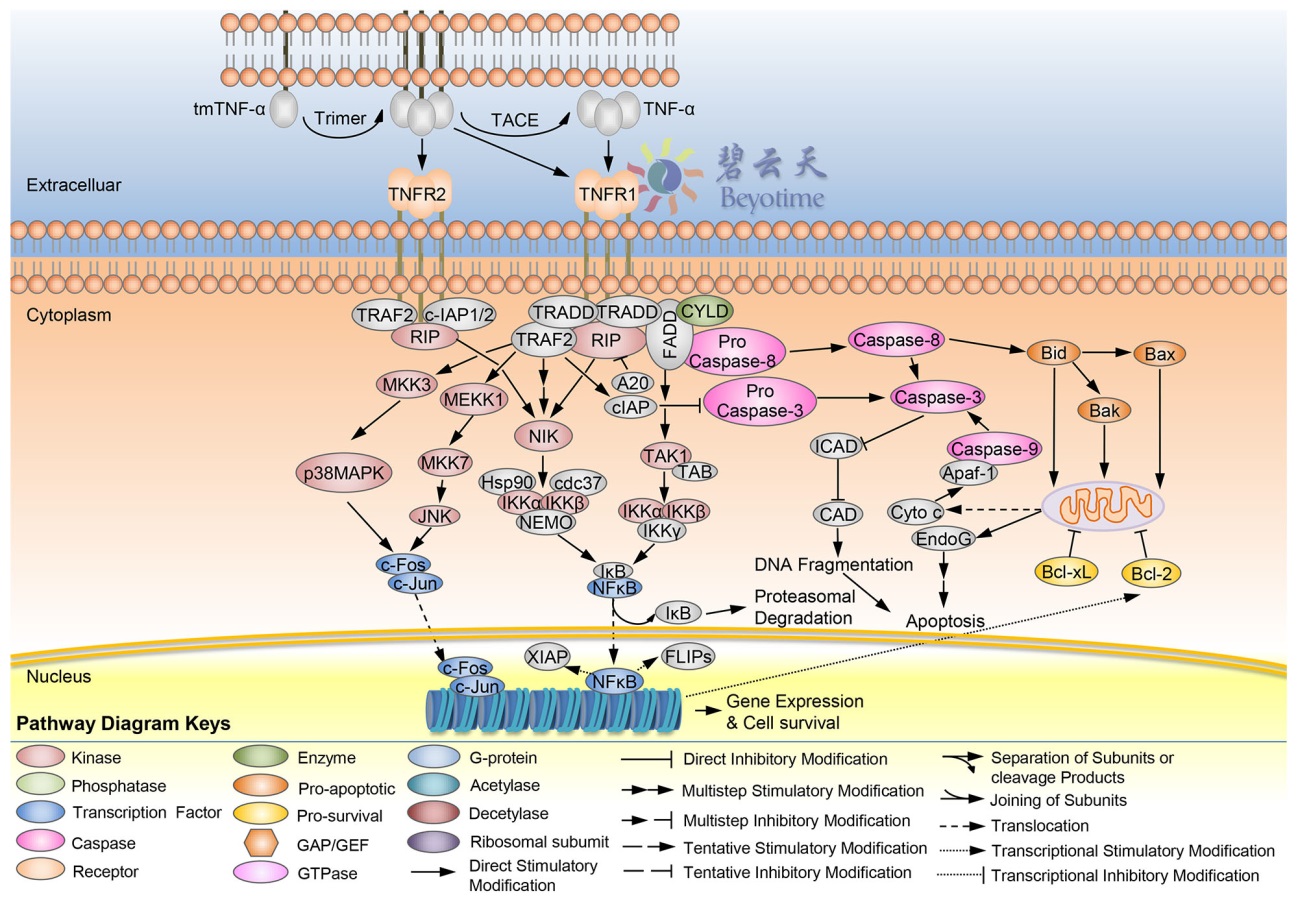
图1. TNF-α的信号通路示意图
TNF-α被诱导分泌后,其同源三聚体与受体TNFR1(TNF receptor, type I)或TNFR2(TNF receptor, type II)结合而引发其下游信号通路的一系列反应。TNF-α的信号通路参见图1。TNFR1在大多数组织中有表达,而TNFR2主要在免疫细胞中表达。TNF-α的跨膜同源三聚体和可溶性同源三聚体都可以完全激活TNFR1,而TNFR2仅对TNF-α的跨膜同源三聚体产生响应。
本试剂盒采用双抗体夹心ELISA法(Sandwich ELISA)检测样品中靶蛋白的的浓度,其原理见图2。靶蛋白特异的单克隆捕获抗体已预包被于酶标板上,当加入标准品或样品时,其中的靶蛋白会与捕获抗体结合。当加入生物素化的抗靶蛋白抗体后,生物素化抗靶蛋白抗体与靶蛋白结合,形成夹心的免疫复合物。随后加入辣根过氧化物酶标记Streptavidin(HRP-Streptavidin),由于生物素与链霉亲和素(Streptavidin)可以特异性地结合,因此链霉亲和素连接的HRP就会与夹心的免疫复合物连接起来而被固相捕获。最后加入显色剂TMB溶液,固相捕获的辣根过氧化物酶就会催化无色的显色剂氧化成蓝色物质,在加入终止液后呈黄色。通过酶标仪检测450nm处的吸光度值就能实现定量检测。靶蛋白浓度与A450值呈正比,通过绘制标准曲线,对照样品吸光度值,即可计算出样品中靶蛋白浓度。
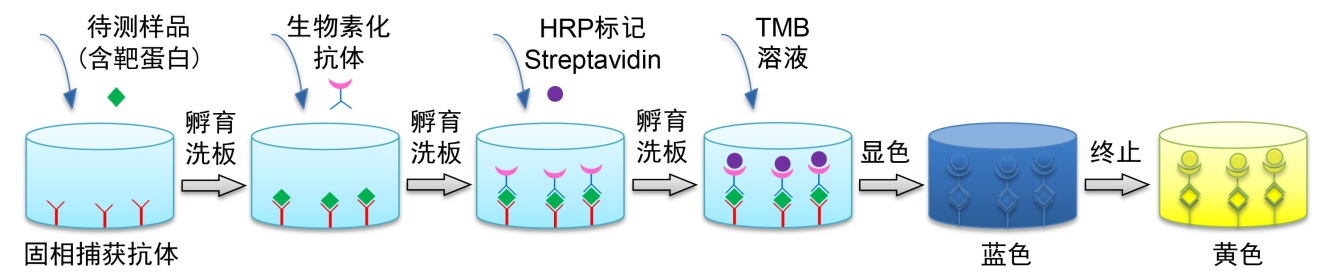
图2. 双抗体夹心ELISA原理图。
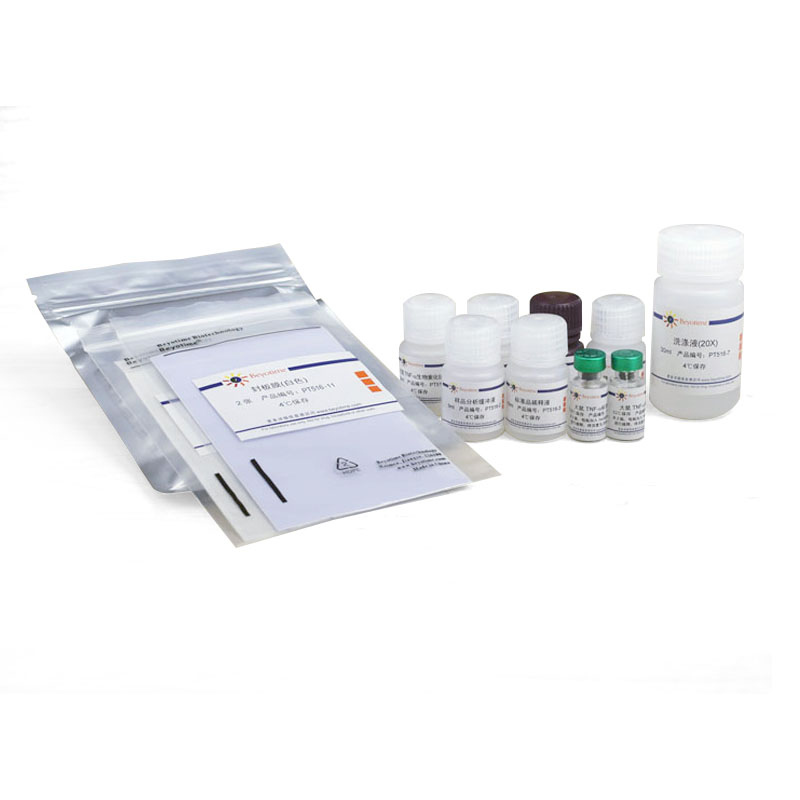
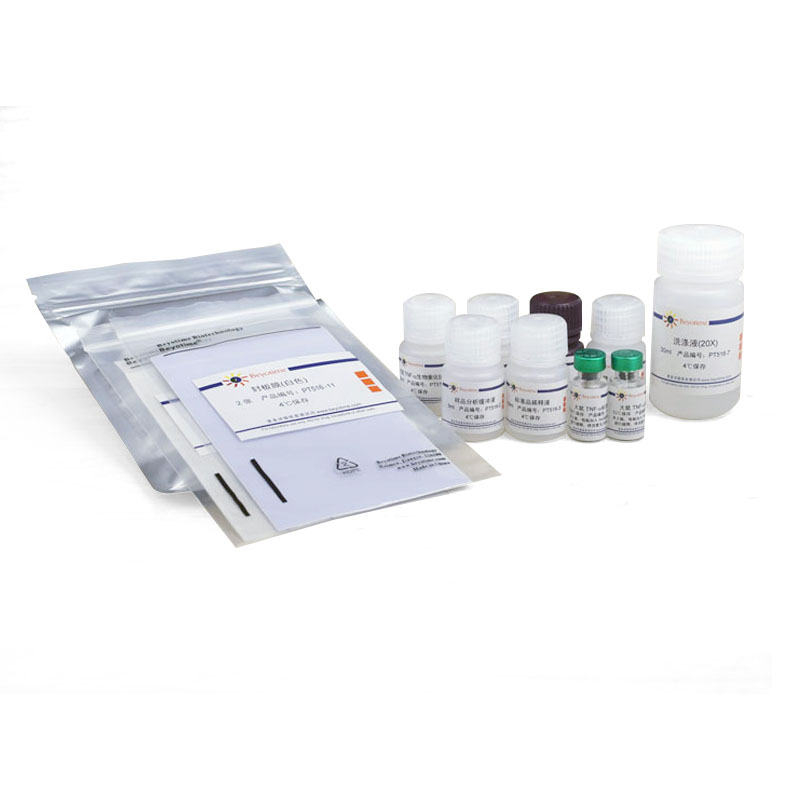
一个包装的本试剂盒,包括标准品检测,可以进行96次检测。
包装清单:
| 产品编号 | 产品名称 | 包装 |
| PT516-1 | 大鼠TNF-α抗体预包被板 | 8孔×12条 |
| PT516-2 | 样品分析缓冲液 | 5ml |
| PT516-3 | 标准品稀释液 | 10ml |
| PT516-4 | 大鼠TNF-α标准品 | 2-4瓶 |
| PT516-5 | 大鼠TNF-α生物素化抗体 | 10ml |
| PT516-6 | 辣根过氧化物酶标记Streptavidin | 10ml |
| PT516-7 | 洗涤液(20X) | 30ml |
| PT516-8 | TMB溶液 | 10ml |
| PT516-9 | 终止液 | 5ml |
| PT516-10 | 封板膜(透明) | 2张 |
| PT516-11 | 封板膜(白色) | 2张 |
| — | 说明书 | 1份 |
保存条件:
除标准品外,4℃保存6个月内有效。标准品4℃保存,1-2周内有效,-20℃保存6个月内有效。注意TMB溶液避光保存。
注意事项:
由于标准品一般是冻干粉,在制备后需要严格校准,所以标准品的瓶数及每瓶标准品所需加入的稀释液体积请以实际收到的试剂盒及标准品标签上的标注为准。
洗涤液(20X)在低温下可能有结晶,如果发现有结晶,请室温水浴加热使结晶完全溶解后再配制工作液。
为保证标准品的精确性,标准品配制使用后,如果有剩余请勿再次使用。
TMB对人体有刺激性,操作时请小心,并注意适当防护以避免直接接触人体或吸入体内。
如果发现TMB辣根过氧化物酶显色液出现混浊或颜色变成蓝色,应该停止使用。
加样时,请注意每个样品或标准品必须更换枪头,一方面避免交叉污染,另一方面也避免吸取体积的误差。
不宜混用不同批号的试剂盒组份,每批次试剂盒均经过独立测试。
充分混匀对保证反应结果的精准性很重要,在加液后请轻轻晃动整个96孔板,以保证混匀。
本试剂盒很多操作在室温进行,要求严格控制室温在25-28℃。温度低于25℃会导致最终检测到的吸光度显著下降。
洗涤过程非常重要,洗涤不充分会使精确度下降并导致结果误差较大。
检测标准品和样品时建议设置重复孔,以确保检测结果的可信度。
加样过程中须避免气泡的产生。
本产品仅限于专业人员的科学研究用,不得用于临床诊断或治疗,不得用于食品或药品,不得存放于普通住宅内。
为了您的安全和健康,请穿实验服并戴一次性手套操作。
使用说明:
1. 样品准备
a. 样品的准备请按下列流程进行操作:
(a) 细胞上清样品离心取上清即可(如100-500g,5分钟)。
(b) 对于血清样品,将全血在室温下放置30分钟至2小时,不要剧烈摇晃以免溶血,待全血自然凝固并析出血清后,4℃约1000-2000g离心10分钟,取黄色上清即得血清,注意不要吸取白色或淡黄色沉淀。制备好的血清需置于冰上待用。
(c) 对于血浆样品,采集的全血使用肝素或者EDTA进行抗凝处理,混匀后置冰上,4℃约1000-2000g离心10分钟,取黄色或淡黄色上清即得血浆,注意不要吸取白色沉淀。制备好的血浆需置于冰上待用。
(d) 若待测样品不能及时检测,样品制备后请分装,冻存于-20℃或-80℃,并注意避免反复冻融。
b. 血清样品不应添加任何防腐剂或抗凝剂。
c. 样品应清澈透明,检测前样品中如有悬浮物应通过离心去除。
d. 请勿使用溶血、高血脂或污染的样品检测,否则结果将不准确。
注:血清或血浆样品可能需要用样品分析缓冲液适当稀释后再检测。
2. 检测前准备工作
a. 试剂盒从冰箱中取出后应置室温(25-28℃)平衡20分钟;每次检测后剩余试剂请及时置于4℃保存。
b. 配制适当量的洗涤液:将洗涤液(20X)用双蒸水或去离子水稀释至1X,例如10ml洗涤液(20X)加190ml水混匀后即为1X的洗涤液。
c. 按标准品标签上标注的体积加入标准品稀释液至1瓶标准品中,室温孵育15分钟(为确保标准曲线的准确性,切勿缩短孵育时间)。随后轻轻混匀并用移液枪吹打几次使标准品彻底溶解,使标准品终浓度达到2000pg/ml。通常每个浓度的标准品需要检测2个孔,每个孔的标准品用量为100μl,共需200μl,同时稀释时还需要使用250μl,因此如果1瓶标准品配制后的体积不足0.45ml,请使用更多瓶数的标准品,并在合并混匀后使用。
d. 取5个洁净的1.5毫升离心管,每管预先加入250μl的标准品稀释液,并参考图3进行标准品的倍比稀释,最终得到2000、1000、500、250、125、62.5pg/ml共六个标准品浓度,最后将稀释好的标准品依次加入预包被板孔中,标准品稀释液直接加入作为0pg/ml浓度,共七个标准品浓度。

图3. 标准品倍比稀释示意图。按标准品(STANDARD)标签上标注体积加入标准品稀释液溶解并混匀后的浓度为标准品的起始浓度。其它的倍比稀释后的浓度依次为起始浓度的1/2、1/4、1/8、1/16和1/32。
3. 洗涤方法
自动洗板机或手工洗板:每孔洗涤液为300μl,注入与吸出间隔15-30秒。洗板5次。最后一次洗板完成后将板倒扣在厚吸水纸上适当用力拍干。
4. 实验过程需自备的材料和仪器
a. 不同规格的移液枪及相应的吸头
b. 酶标仪
c. 自动洗板机(如果没有也可以手工洗板)
d. 去离子水或双蒸水
5. 操作步骤
a. 计算并确定一次实验所需的预包被板条数,取出所需板条放置在96孔框架内,暂时用不到板条请放回铝箔袋密封,保存于4℃。
b. 每次实验都需配制标准品并绘制出标准曲线,同时建议设置本底较正孔,即空白孔,设置方法为该孔只加TMB溶液和终止液。
c. 分别将样品或不同浓度标准品按照100μl/孔加入相应孔中,用封板膜(透明)封住反应孔,室温孵育120分钟。对于血清或血浆样品,可以加入50μl样品分析缓冲液后加50μl样品;如稀释比例大,将样品与样品分析缓冲液等量加入,不足部分用标准品稀释液补充至100μl。请注意记录好样品的稀释倍数。
注意:请先查阅相关文献确定样品中待检测蛋白的大致浓度,如果该浓度大于或者小于本试剂盒的最高或者最低标准品浓度,请适当稀释或浓缩后再进行检测。
d. 洗板5次,且最后一次置于厚吸水纸上拍干。
e. 加入生物素化抗体100μl/孔(注:此生物素化抗体已经预先配制好,可以直接使用,不必再进行稀释)。用封板膜(透明)封住反应孔,室温孵育60分钟。
f. 洗板5次,且最后一次置于厚吸水纸上拍干。
g. 加入辣根过氧化物酶标记Streptavidin 100μl/孔。用封板膜(白色)封住反应孔,室温避光孵育20分钟。室温偏低时(低于25℃),需要适当延长孵育时间。
h. 洗板5次,且最后一次置于厚吸水纸上拍干。
i. 加入显色剂TMB溶液100μl/孔,用封板膜(白色)封住反应孔,室温避光孵育20分钟。室温偏低时需要适当延长孵育时间,此时可以孵育至标准品和样品出现非常显著的颜色变化。
j. 加入终止液50μl/孔,混匀后立即测量A450值。
6. 结果分析
a. 复孔的值通常在20%的差异范围内结果才有效,复孔平均值可作为测量值。
b. 每个标准品或样品的吸光度值应减去本底校正孔的吸光度值(如果没有做校正孔,则不需要减去)。
c. 绘制标准曲线。以标准品浓度为横坐标,A450值为纵坐标,以平滑线连接各标准品的坐标点。通过样品的吸光度值和标准曲线计算出样品的相应浓度。
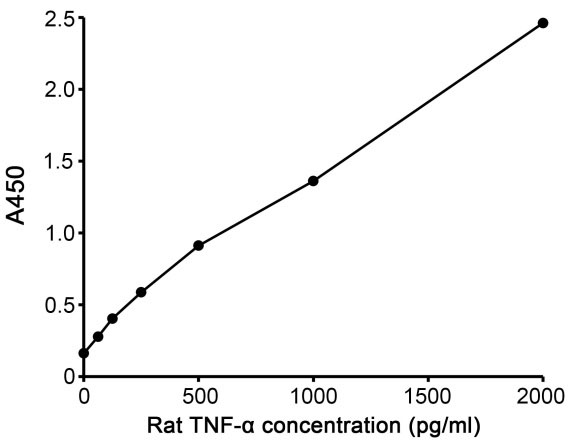
图4. Rat TNF-α ELISA Kit的标准曲线。实测数据会因实验条件、检测仪器等的不同而存在差异,图中数据仅供参考。
d. 若样品OD值高于标准曲线上限,应适当稀释后重新测定,计算浓度时需注意乘以样品的稀释倍数。
相关产品:
| 产品编号 | 产品名称 | 包装 |
| PI301 | Mouse IL-1β ELISA Kit | 96次 |
| PI303 | Rat IL-1β ELISA Kit | 96次 |
| PI305 | Human IL-1β ELISA Kit | 96次 |
| PI326 | Mouse IL-6 ELISA Kit | 96次 |
| PI328 | Rat IL-6 ELISA Kit | 96次 |
| PI330 | Human IL-6 ELISA Kit | 96次 |
| PT512 | Mouse TNF-α ELISA Kit | 96次 |
| PT516 | Rat TNF-α ELISA Kit | 96次 |
| PT518 | Human TNF-α ELISA Kit | 96次 |
| PI602 | Mouse Insulin ELISA Kit (Ultrasensitive) | 96次 |
| PI606 | Rat Insulin ELISA Kit (Ultrasensitive) | 96次 |









 微信在线咨询
微信在线咨询