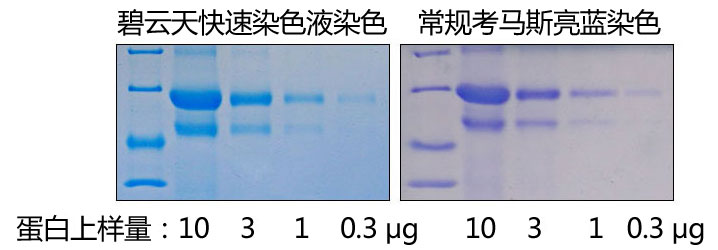
使用本产品的文献:
1. Kang T, Huang Y, Zhu Q, Cheng H, Pei Y, Feng J, Xu M, Jiang G, Song Q, Jiang T, Chen H, Gao X, Chen J
.
Biomaterials.
2018 May;164:80-97.
(IF 10.317)
2. Xin X, Teng C, Du X, Lv Y, Xiao Q, Wu Y, He W, Yin L
.
Theranostics.
2018 Jun 6;8(13):3474-3489.
(IF 8.579)
3. Chen Q, Chen Y, Sun Y, He W, Han X, Lu E, Sha X
.
Nanoscale.
2019 Mar 21 11(12):5377-5394.
(IF 6.895)
4. Ma S, Wang C, Guo M
.
Ultrason Sonochem.
2018 May;43:227-236.
(IF 6.513)
5. Hao Wang, Xiaomeng Sun, Xiao Song, Mingruo Guo
.
Food Chem.
2021 Mar 1;339:128099. doi: 10.1016/j.foodchem.2020.128099.
(IF 6.306)
6. Liang W, Cheng J, Liu R, Wang JP, Mu JG, Wang QH, Wang HJ, Ma D.
.
Peptides.
2009;30(12):2330-6.
(IF 2.843)
7. Yan L, Xu G, Qiao T, Chen W, Yuan S, Li X.
.
CANCER BIOTHER RADIO.
2013 Sep;28(7):559-64.
(IF 2.314)
8. Zhang HH, Pang M, Dong W, Xin JX, Li YJ, Zhang ZC, Yu L, Wang PY, Li BS, Xie SY.
.
Oncol Rep.
2014 Mar;31(3):1473-9.
(IF 3.417)
9. Xing N, Qiao T, Zhuang X, Yuan S, Zhang Q, Xu G.
.
ONCOTARGETS THER.
2015 Jun 12;8:1443-9.
(IF 3.337)
10. Wang X, Zhao B, Li X.
.
Int J Clin Exp Med.
2015 Oct 15;8(10):17281-8.
(IF 0.166)
11. Zhuang X, Qiao T, Xu G, Yuan S, Zhang Q, Chen X.
.
Oncol Rep.
2016 Oct;36(4):2200-6.
(IF 3.417)
12. Zhang K, Zhu X, Lu Y .
.
SCI REP-UK.
2016 Oct 11;6:33917.
(IF 3.998)
13. Ma LM, Liang ZR, Zhou KR, Zhou H, Qu LH .
.
BIOCHEM BIOPH RES CO.
2016 Nov 18;480(3):328-333.
(IF 2.985)
14. Ma Y, Yan Z, Deng X, Guo J, Hu J, Yu Y, Jiao F
.
Oncol Rep.
2018 Jun;39(6):2969-2977.
(IF 3.417)
15. Chang M, Qin Q, Wang B, Xia T, Lv W, Sun X, Shi X, Xu G
.
J Sep Sci.
2019 Feb 42(3):744-753.
(IF 2.878)
16. Geng F, Xie Y, Wang J, Li S, Jin Y, Ma M
.
J POULT SCI.
2019 Mar 1;98(3):1545-1550.
(IF 0.88)
17. Liu W, Guo S, Sun D, Zhu L, Zhu F, Lei CL, Sheng L, Phelps B, Wang XP
.
Comp Biochem Physiol A Mol Integr Physiol.
2019 Mar 229:69-75.
18. Wang C, Wang H, Sun X, Sun Y, Guo M
.
Int J Mol Sci.
2019 Aug 21 20(17). pii: E4089.
(IF 4.556)
19. Xinhui Zhou, Cuina Wang, Xiaomeng Sun, Zixuan Zhao, Mingruo Guo
.
Molecules.
2020 Aug 10;25(16):3637. doi: 10.3390/molecules25163637.
(IF 3.267)
20. Meng Gao, Weitian Lu, Yue Shu, Zhengyu Yang, Shanquan Sun, Jin Xu, Shengwei Gan, Shujuan Zhu, Guoping Qiu, Fei Zhuo, Shiye Xu, Yiying Wang, Junhong Chen, Xuan Wu, Juan Huang
.
CNS Neurosci Ther.
2020 Dec;26(12):1288-1302. doi: 10.1111/cns.13446.
(IF 4.074)
21. Jinqiu Wang, Jing Xiao, Xin Liu, YuLing Gao, Zhang Luo, Xuedong Gu, Jiamin Zhang, Di Wu, Fang Geng
.
Meat Sci.
2021 Feb;172:108343. doi: 10.1016/j.meatsci.2020.108343.
(IF 3.644)
22. Wei Yuan, Liaoxun Lu, Muding Rao, Yang Huang, Chun-E Liu, Shuang Liu, Yue Zhao, Huicong Liu, Jiangli Zhu, Tianzhu Chao, Can Wu, Junyan Ren, Luxian Lv, Wenqiang Li, Shiqian Qi, Yinming Liang, Shijing Yue, Jian Gao, Zhongjian Zhang, Eryan Kong
.
Proc Natl Acad Sci U S A.
2021 Mar 30;118(13):e2022261118. doi: 10.1073/pnas.2022261118.
23. Manchen Bao, Zhaoxing Sun, Xiaoxiao Yang, Jun Ji, Lin Zhang, Bo Xiang, Guoquan Yan, Xiaoqiang Ding, Jianzhou Zou, Xiaofang Yu
.
J Proteomics.
2021 Jun 30;242:104260. doi: 10.1016/j.jprot.2021.104260.
(IF 3.509)
24. Jun-Ling Wang, Wei-Guang Chen, Jia-Jia Zhang, Chao-Jin Xu
.
J Mol Histol.
2021 Jun;52(3):521-537. doi: 10.1007/s10735-021-09960-6.
(IF 2.531)
25. Le Gao, Fang-Zi Gong, Lu-Yao Ma, Jian-Hong Yang
.
Exp Ther Med.
2021 Aug;22(2):880. doi: 10.3892/etm.2021.10312.
(IF 1.785)
26. Lili Bao, Geng Dou, Ran Tian, Yajie Lv, Feng Ding, Siying Liu, Ruifeng Zhao, Lu Zhao, Jun Zhou, Lin Weng, Yan Dong, Bei Li, Shiyu Liu, Xin Chen, Yan Jin
.
Bioact Mater.
2021 Aug 27:9:183-197. doi: 10.1016/j.bioactmat.2021.08.008.
27. Yang Liu, Baozeng Sun, Jingyu Pan, Yuancai Feng, Wei Ye, Jiahao Xu, Mingfu Lan, Hao Sun, Xiyang Zhang, Yuanjie Sun, Shuya Yang, Jingqi Shi, Fanglin Zhang, Linfeng Cheng, Dongbo Jiang, Kun Yang
.
Antiviral Res.
2021 Sep;193:105141. doi: 10.1016/j.antiviral.2021.105141.
28. Chao-Jin Xu, Mei-Qi Li, Li-Zhao, Wei-Guang Chen, Jun-Ling Wang
.
Aging (Albany NY).
2021 Oct 7;13(19):23133-23148. doi: 10.18632/aging.203607.
29. Yuanjie Sun, Xiyang Zhang, Shuya Yang, Chenchen Hu, Jingyu Pan, Tianyue Liu, Jiaqi Ding, Chenying Han, Yinan Huang, Kun Yang
.
Int Immunopharmacol.
2022 Feb:103:108505. doi: 10.1016/j.intimp.2021.108505.
(IF 3.943)
30. Jiawen Zhang, Peiying Zheng, Jing Li, Yijing Yang, Shaoxiao Zeng, Jianqing Qiu, Shaoling Lin
.
Foods.
2022 Mar 11;11(6):808. doi: 10.3390/foods11060808.
(IF 4.092)
31. Lexin He, Shixiang Zhou, Weihong Li, Qi Wang, Zhenhua Qi, Pingkun Zhou, Zhidong Wang, Jing Chen, Yaqiong Li, Zhongwu Lin
.
Dose Response.
2022 Apr 11;20(1):15593258221086478. doi: 10.1177/15593258221086478.
32. Yinuo Yang, Shouping Zhang, Jindong Guan, Yuhui Jiang, Jing Zhang, Lan Luo, Cheng Sun
.
Biochim Biophys Acta Mol Basis Dis.
2022 May 1;1868(5):166365. doi: 10.1016/j.bbadis.2022.166365.
33. Mengmeng Zhang, Lu Wang, Jinyao Liu, Yan Pang
.
iScience.
2022 May 30;25(6):104490. doi: 10.1016/j.isci.2022.104490.
34. Jun Gao, Wenchao Li, Zhongjian Zhang, Wenshan Gao, Eryan Kong
.
Reprod Sci.
2022 Aug;29(8):2299-2309. doi: 10.1007/s43032-022-00919-w.
(IF 2.616)



 微信在线咨询
微信在线咨询











 微信在线咨询
微信在线咨询