


 微信在线咨询
微信在线咨询

| 产品编号 | 产品名称 | 产品包装 | 产品价格 |
| P2132-0.5ml | BeyoMag™ Anti-GFP Magnetic Beads (Anti-GFP磁珠) | 0.5ml | 825.00元 |
| P2132-2ml | BeyoMag™ Anti-GFP Magnetic Beads (Anti-GFP磁珠) | 2ml | 2482.00元 |
碧云天生产的BeyoMag™ Anti-GFP Magnetic Beads,即Anti-GFP磁珠,也称Anti-GFP免疫磁珠或GFP抗体磁珠,是由高品质的GFP小鼠单克隆抗体与纳米级氨基磁珠共价偶联而成,可特异性地与动植物或微生物裂解液、血清、腹水等中含有GFP标签的蛋白结合,从而用于带有GFP标签的融合蛋白或其蛋白复合物的免疫沉淀(Immunoprecipitation, IP)、免疫共沉淀(Co-IP)或纯化。
GFP标签(GFP-tag)、Flag标签(Flag-tag)、Myc标签(Myc-tag)、HA标签(HA-tag)、 His标签(His-tag)和GST标签(GST-tag)等是表达载体上最常见的一些标签,通过与这些标签的融合表达可以非常方便地检测目的蛋白及与目的蛋白相互结合的蛋白,也可以非常方便地用于目的蛋白的纯化。
GFP (green fluorescent protein, 绿色荧光蛋白)最早是由下村修、钱永健等人于1962年在维多利亚多管发光水母(Aequorea victoria)中发现的,当受到紫外或蓝光激发时,发射绿色荧光。GFP或其突变体EGFP (enhanced green fluorescent protein, 增强型绿色荧光蛋白)与目的蛋白融合表达被广泛用于基团表达调控、转基因功能、目的蛋白在细胞中的表达、分布和迁移、以及高通量药物筛选等方面的研究。GFP标签的优点是便于观察,适合于观察蛋白在细胞内的定位,不用破碎组织细胞、不加任何底物、不用抗体,直接通过荧光显微镜就能在活细胞中观察到发出的绿色荧光,实时观察目的蛋白的表达情况,而且荧光性质稳定,细胞内的其它产物不会干扰GFP标签蛋白的检测,从而使其检测快速、简便、灵敏度高、重现性强,所以GFP被誉为活细胞探针。但GFP标签的分子量较大,约为25kDa,与目的基因形成融合蛋白时可能会影响目的蛋白的功能。
BeyoMag™ Anti-GFP Magnetic Beads (Anti-GFP磁珠)可以特异性地结合GFP或EGFP等标签融合蛋白,并可以借助磁力架等磁分离设备非常便捷地应用于带有GFP标签的融合蛋白或其蛋白复合物的免疫沉淀或纯化等实验。本产品进行免疫沉淀的流程参考图1。

图1. 碧云天的BeyoMag™ Anti-GFP Magnetic Beads (Anti-GFP磁珠)免疫沉淀流程图。
本产品特异性强、靶蛋白结合量高。与国内外大多数的同类产品相比,本产品抗体结合密度高,对带有GFP标签蛋白的结合具有很强的特异性,并且本产品磁珠粒径小,不易产生非特异吸附。本产品每毫升磁珠悬浊液含约10mg磁珠,含有不少于0.6mg GFP抗体,通常可结合不少于0.6mg GFP标签融合蛋白,具体的最大结合量和标签蛋白的分子量大小等相关。每500微升样品,通常仅需使用10-20微升磁珠悬浊液,就可以高效地进行免疫沉淀实验。
本产品可结合多种形式的GFP标签蛋白。本产品可特异性地结合N端GFP融合蛋白(GFP-Protein)、C端GFP融合蛋白(Protein-GFP)。
本产品结合目的蛋白速度快。本产品使用了纳米级磁珠(~200nm),具有超大的比表面积,便于抗体和抗原的快速有效结合。通常10分钟内即可完成抗原吸附的过程,30分钟内完成目的蛋白免疫沉淀操作。缩短操作时间可以有效避免在长时间操作过程中目的蛋白的降解或变性,充分保证目的蛋白的活性。
本产品可选择多种洗脱方法。本产品可以根据目的蛋白的结构、生物学功能及后续应用的要求等,使用多种洗脱方法,包括SDS-PAGE上样缓冲液和酸性等洗脱液进行洗脱。本产品用于GFP-融合蛋白的免疫沉淀效果参考图2。
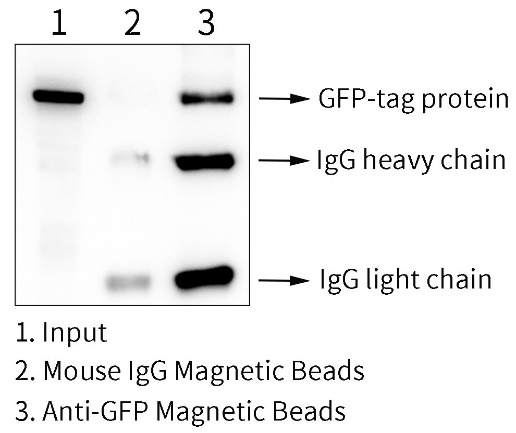
图2. BeyoMag™ Anti-GFP Magnetic Beads (Anti-GFP磁珠)用于GFP-融合蛋白的免疫沉淀效果图。293T (人胚肾细胞)转染含GFP-tag质粒36小时后,经Western及IP细胞裂解液(P0013)裂解。样品1为Input,即全细胞裂解液(total);样品2为Mouse IgG Magnetic Beads (小鼠IgG免疫磁珠) (P2171)免疫沉淀后经SDS-PAGE蛋白上样缓冲液(1X) (P0015A)洗脱后的样品,该Mouse IgG是正常的小鼠IgG (Normal Mouse IgG),为阴性对照;样品3为本磁珠免疫沉淀后的样品,该样品使用SDS-PAGE蛋白上样缓冲液(1X)洗脱。使用SDS-PAGE蛋白上样缓冲液(1X)洗脱后可以检测到GFP抗体的轻重链。Western印迹成像由BeyoImager™ 600化学发光成像系统完成(EI600)。实际结果会因实验条件、检测仪器等的不同而存在差异,图中数据仅供参考。
本产品的主要指标如下表:
| Characteristics | Description |
| Product content | 10mg/ml magnetic beads in specific protective buffer |
| Beads size | ~200nm |
| Magnetization | Superparamagnetic |
| Coupled antibody | Anti-GFP mouse monoclonal antibody |
| Isotype | IgG1 |
| M.W. of antibody | Approximately 150kDa |
| Antibody concentration | ≥0.6mg GFP antibody per ml beads |
| Binding capacity | ≥ 0.6mg GFP‐tagged fusion protein per ml beads |
| Specificity | GFP-Protein, Protein-GFP |
| Elution method | SDS‐PAGE loading buffer, or acid elution. Note: If elute with SDS-PAGE loading buffer, the light (~25kDa) and heavy (~50kDa) chain of GFP antibody will be denatured and release from the beads. |
| Application | IP, Co-IP, Protein purification |
| 产品编号 | 产品名称 | 包装 |
| P2132-0.5ml | BeyoMag™ Anti-GFP Magnetic Beads (Anti-GFP磁珠) | 0.5ml |
| P2132-2ml | BeyoMag™ Anti-GFP Magnetic Beads (Anti-GFP磁珠) | 2ml |
| - | 说明书 | 1份 |
-20ºC保存,两年有效。4ºC保存,至少三个月内有效。
注意事项:本Anti-GFP磁珠使用的GFP抗体的抗原为GFP蛋白的N端约20个氨基酸的多肽,由于GFP标签本身的分子量较大,约25kDa,与目的基因形成融合蛋白后分子量更大,而且融合蛋白的结构复杂性可能会影响Anti-GFP磁珠对GFP蛋白N端的识别,建议通过预实验进行免疫沉淀的验证或对裂解条件进行一定的调整。
由于GFP-tag与GFP抗体的结合力非常强,酸性洗脱的效果可能比较差,建议优先使用SDS-PAGE上样缓冲液洗脱法。
本产品需维持pH为6-8,避免高速离心和干燥;请勿长时间将磁珠置于磁场中,否则可能会引起磁珠聚团。
本产品使用前要适当充分重悬,即颠倒若干次使磁珠混合均匀,混匀操作须轻柔,不宜剧烈涡旋震荡等,避免抗体变性等。
在免疫沉淀或纯化时,建议设置阳性和阴性对照组。
蛋白样品收集后宜尽快完成纯化工作,并应始终放置在4℃或冰浴,以减缓蛋白降解或变性。为有效抑制蛋白降解,可以在蛋白样品中添加适量的蛋白酶抑制剂混合物,例如碧云天的P1005/P1006蛋白酶抑制剂混合物(通用型)、P1048/P1049 蛋白酶磷酸酶抑制剂混合物(通用型, 质谱兼容, 50X)、P1010/P1011 蛋白酶抑制剂混合物(哺乳动物样品抽提用, 100X)、P1050/P1051 蛋白酶磷酸酶抑制剂混合物(哺乳动物样品抽提用, 50X)等。
如果使用真空泵等仪器吸取上清液,须注意真空泵的吸液强度,以免吸力过大而吸取到聚集的磁珠。
酸性溶液洗脱时磁珠可能会发生聚集,属于正常现象,不影响磁珠的正常使用。0.1%的非离子型去垢剂(如Triton X-100、Tween-20或NP-40)可有效防止磁珠聚集,并且不会影响磁珠的抗体结合效率。
高浓度的DTT、巯基乙醇、盐酸胍等对本产品与标签蛋白的结合可能有一定影响,但Western及IP细胞裂解液(P0013)、RIPA裂解液(P0013B/C/D)或NP-40裂解液(P0013F)等都完全适用。碧云天生产的不同裂解液的主要特点和差异,以及如何选择裂解液可参考我们的相关网页:http://www.beyotime.com/support/lysis-buffer.htm。
本产品仅限于专业人员的科学研究用,不得用于临床诊断或治疗,不得用于食品或药品,不得存放于普通住宅内。
为了您的安全和健康,请穿实验服并戴一次性手套操作。
| Problem | Possible Causes | Solution |
| Very few or no GFP‐tagged protein exists in the eluate. | Protein is not completely eluted. | Change elution methods. |
| No target protein expressed. | Make sure the protein of interest contains the GFP-tag by Western blot or dot blot analyses. | |
| Very low protein expression level. | 1. Use larger volume of cell lysate. 2. Optimize expression conditions to raise the protein expression level. |
|
| Washes are too stringent. | Reduce the time and number of washes. | |
| Incubation times are inadequate. | Increase the incubation time. | |
| Interfering substance is present in sample. | Lysates containing high concentration of DTT, 2-mercaptoethanol, or other reducing agents may destroy antibody function, and must be avoided. | |
| Detection system is inadequate. | If Western blot detection is used: 1. Check primary and secondary antibodies using proper controls to confirm binding and reactivity. 2. Verify that the transfer was adequate by using prestained protein marker or staining the membrane with Ponceau S. 3. Use fresh detection substrate or try a different detection system. |
|
| Background is too high. | Proteins bind nonspecifically to the Anti-GFP monoclonal antibody, insufficient washing on magnetic beads, or the microcentrifuge tubes. | 1. Pre-clear lysate with Mouse IgG Magnetic Beads (P2171) to remove nonspecific binding proteins. 2. After suspending beads for the final wash, transfer entire sample to a clean microcentrifuge tube before centrifugation. |
| Washes are insufficient. | 1.Increase the number of washes. 2.Prolong duration of the washes, incubating each wash for at least 15 minutes. 3.Increase the salt and/or detergent concentrations in the wash solutions. 4.Centrifuge at lower speed to avoid nonspecific trapping of denatured proteins. |
|
| Multiple protein bands found in the eluate. | The protein is not stable at room temperature. | Purify the target protein at lower temperature, such as 4℃. |
| Protein degradation due to proteases activity during purification process. | Add protease inhibitors to cell lysate. | |
| Non‐specific binding. | 1.Prepare cell lysate again. 2.Add additional wash steps. |









 微信在线咨询
微信在线咨询












