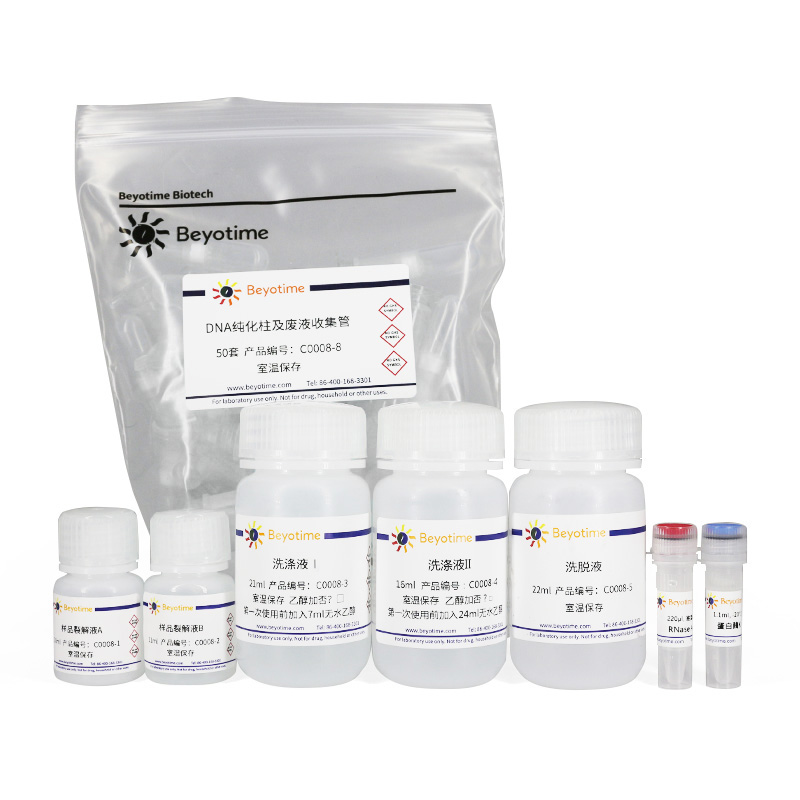
使用本产品的文献:
1. Junfang Li, Xiaoling Hu, Honghua Zhang, Yan Peng, Shuang Li, Yongxia Xiong, Weifan Jiang, Zhen Wang
.
J Med Chem.
2022 Aug 11;65(15):10481-10505. doi: 10.1021/acs.jmedchem.2c00635.
(IF 6.205)
2. Wang N, Hou L, Zhu ZY, Zhang JY, Ju CX, Ge YL, Yue W.
.
《中国药理学通报》.
2007 May;23(5):680-4.
3. Qian YF, Yao WB, Wang H, Gao XD.
.
CHIN J NAT MEDICINES.
2007
Sep;5(5):379-384.
(IF 2.014)
4. Qian YF, Wang H, Yao WB, Gao XD.
.
Cell Biol Int.
2008 Feb;32(2):304-11.
(IF 2.571)
5. Bai Y, Li Q, Yang J, Zhou X, Yin X, Zhao D.
.
Neurosci Res.
2008 Sep;62(1):9-14.
(IF 2.645)
6. Cai L, Wang H, Li Q, Qian Y, Yao W.
.
ACTA BIOCH BIOPH SIN.
2008 Sep;40(9):796-802.
(IF 2.836)
7. Wang H, Xu Y, Yan J, Zhao X, Sun X, Zhang Y, Guo J, Zhu C.
.
Brain Res.
2009 Aug 4;1283:139-47.
(IF 2.733)
8. Li J, Xu Z, Tan M, Su W, Gong XG.
.
CHEM-BIOL INTERACT.
2010 Feb 12;183(3):341-8.
(IF 3.723)
9. Chai J, Xiong Q, Zhang P, Zheng R, Peng J, Jiang S.
.
GEN COMP ENDOCR.
2010 Apr 1;166(2):241-9.
(IF 2.426)
10. Wang L, Xu T, Lei WW, Liu DM, Li YJ, Xuan RJ, Ma JJ
.
PLoS One.
2011 Nov;6(11):e27853.
(IF 2.74)
11. Zhu H, Xia L, Zhang Y, Wang H, Xu W, Hu H, Wang J, Xin J, Gang Y, Sha S, Xu B, Fan D, Nie Y, Wu K
.
PLoS One.
2012 Feb;7(2):e31431.
(IF 2.74)
12. Lu B, Xu Y, Xu L, Cong X, Yin L, Li H, Peng J.
.
ENVIRON TOXICOL CHEM.
2012 Mar 30;34(2):127-135.
(IF 3.152)
13. Gao Q, Qi L, Wu T, Wang J.
.
BMC Microbiol.
2012 Jun 8;12(1):100.
(IF 2.989)
14. Wang J, Wang Q, Li J, Shen Q, Wang F, Wang L
.
COMP BIOCHEM PHYS C.
2012 Nov;156(3-4):195–201.
(IF 2.892)
15. Zhang WJ, Zhang WG, Zhang PY, Cao XM, He AL, Chen YX, Gu LF.
.
Oncol Rep.
2013 Feb;29(2):491-506.
(IF 3.417)
16. Wang B, Yu T, Dong X, Zhang Z, Song L, Xu Y, Zhang XH.
.
Vet Microbiol.
2013 May 3;163(3-4):282-9.
(IF 3.03)
17. Ji MM, Liu AQ, Gan LP, Xing R, Wang H, Sima YH, Xu SQ.
.
Insect Mol Biol.
2013 Jun;22(3):273-83.
(IF 2.533)
18. Liao Y, Shen W, Kong G, Lv H, Tao W, Bo P.
.
PLoS One.
2014 Mar 19;9(3):e92007.
(IF 2.74)
19. Li LJ, Xu NW, Gao RL, Lin XJ, Qiu HY, Liu WH, Jin YJ, Zhao ML.
.
Chin J Integr Med.
2014 May;20(5):381-6.
(IF 1.545)
20. Wang T, Zhou J, Gan X, Wang H, Ding X, Chen L, Wang Y, DU J, Shen J, Yu L.
.
Parasitology.
2014 Jun;141(7):988-95.
(IF 2.783)
21. Xie W, Chen C, Jiang Z, Wang J, Melzig MF, Zhang X.
.
AM J CHINESE MED.
2015;43(3):457-76.
(IF 3.682)
22. Zhang X, Luo W, Zhao W, Lu J, Chen X.
.
J Breast Cancer.
2015 Jun;18(2):112-8.
(IF 2.241)
23. Yang J, Zong X, Wu G, Lin S, Feng Y, Hu J.
.
Amino Acids.
2015 Aug;47(8):1549-58.
(IF 3.063)
24. Chen W, Zheng X, Li S, Zhang W, Wen X, Yue L, Wang J.
.
Journal of Nanoparticle Research.
2015 Nov;17(11):1-10.
(IF 2.009)
25. Wang H, Wang Y, Wu C, Tao H, Chen X, Yin W, Sima Y, Wang Y, Xu S.
.
J Comp Physiol B.
2016 Aug;186(6):689-700.
(IF 2.042)
26. Huang J, Peng K, Wang L, Wen B, Zhou L, Luo T, Su M, Li J, Luo Z.
.
ACTA BIOCH BIOPH SIN.
2016 Aug;48(8):750-5.
(IF 2.836)
27. Zhang C, Li XN, Xiang LR, Qin L, Lin J, Li JL.
.
ECOTOX ENVIRON SAFE.
2017 Mar;137:49-56.
(IF 4.872)
28. Zhang C, Li XN, Xiang LR, Qin L, Lin J, Li JL.
.
ECOTOX ENVIRON SAFE.
2017 Mar;137:49-56.
(IF 4.872)
29. Xiao R, Xiang AL, Pang HB, Liu KQ.
.
Gene.
2017 Sep 20;629:86-91.
(IF 2.984)
30. Li S, Zhao H, Wang Y, Shao Y, Liu J, Xing M
.
J POULT SCI.
2019 Feb 1;98(2):734-744.
(IF 0.88)
31. Pengfei Yuan, Liangliang Lei, Shuaijun Dong, Dechun Liu
.
ONCOTARGETS THER.
2020 Mar 4;13:1921-1929. doi: 10.2147/OTT.S223542.
(IF 3.337)
32. Weiwei Li, Jiancheng Yang, Qiufeng Lyu, Gaofeng Wu, Shumei Lin, Qunhui Yang, Jianmin Hu
.
Mol Cell Biochem.
2020 Jun;469(1-2):119-132. doi: 10.1007/s11010-020-03733-7.
(IF 2.795)
33. Xiuge Gao, Xiangchun Ruan, Hui Ji, Lin Peng, Yawei Qiu, Dan Yang, Xinhao Song, Chunlei Ji, Dawei Guo, Shanxiang Jiang
.
Toxicol Lett.
2020 Oct 15;333:105-114. doi: 10.1016/j.toxlet.2020.07.025.
(IF 3.569)
34. Yuxin Fang, Yunhui Zhu, Ling Li, Zhenheng Lai, Na Dong, Anshan Shan
.
Small Methods.
2021 Dec;5(12):e2101304. doi: 10.1002/smtd.202101304.
35. Fei Liu, Ying Zhang, Fan Wang
.
Environ Toxicol.
2022 Apr;37(4):848-857. doi: 10.1002/tox.23448.
(IF 3.118)
36. Feng-Feng Wang, Peng-Yu Zhao, Xian-Jing He, Kai Jiang, Tian-Shuo Wang, Jia-Wei Xiao, Dong-Bo Sun, Dong-Hua Guo
.
Front Cell Infect Microbiol.
2022 Jun 14:12:827750. doi: 10.3389/fcimb.2022.827750.



 微信在线咨询
微信在线咨询










 微信在线咨询
微信在线咨询