微信在线咨询
微信在线咨询

| 产品编号 | 产品名称 | 产品包装 | 产品价格 |
| D3106 | 生物素3'末端DNA标记试剂盒 | 20次 | 1539.00元 |
生物素3'末端DNA标记试剂盒(Biotin 3' End DNA Labeling Kit)是一种通过Terminal Deoxynucleotidyl Transferase(TdT)把生物素标记的dUTP添加到DNA 3'末端的试剂盒。通常DNA的3'末端被标记后不会干扰杂交反应,也不会干扰基于序列特异性蛋白结合的EMSA检测;因此生物素标记的DNA探针可以用于常规的Northern、Southern、EMSA(即gel shift)以及colony hybridization或原位杂交等。
Terminal Deoxynucleotidyl Transferase(TdT)可以在不依赖于模板的情况下催化在DNA的3'-OH端加上dNTP的反应。关于TdT催化双链DNA末端加dNTP的反应效率,3'端突出的双链DNA要比平端或3'端缩进的双链DNA高很多。TdT催化单链DNA末端加dNTP的反应效率要比双链DNA高很多。在适当的条件下,TdT也可以催化RNA 3'末端加NTP的反应。
本试剂盒适合标记纯化的单链DNA,如果用于标记EMSA探针,可以在单链标记后再进行退火。
本试剂盒中提供了已经用生物素标记好的Biotin-Control Oligo,可以用作检测DNA标记效率的对照。
如果每个标记反应的探针量为5pmol,本试剂盒可以用于20个标记反应。
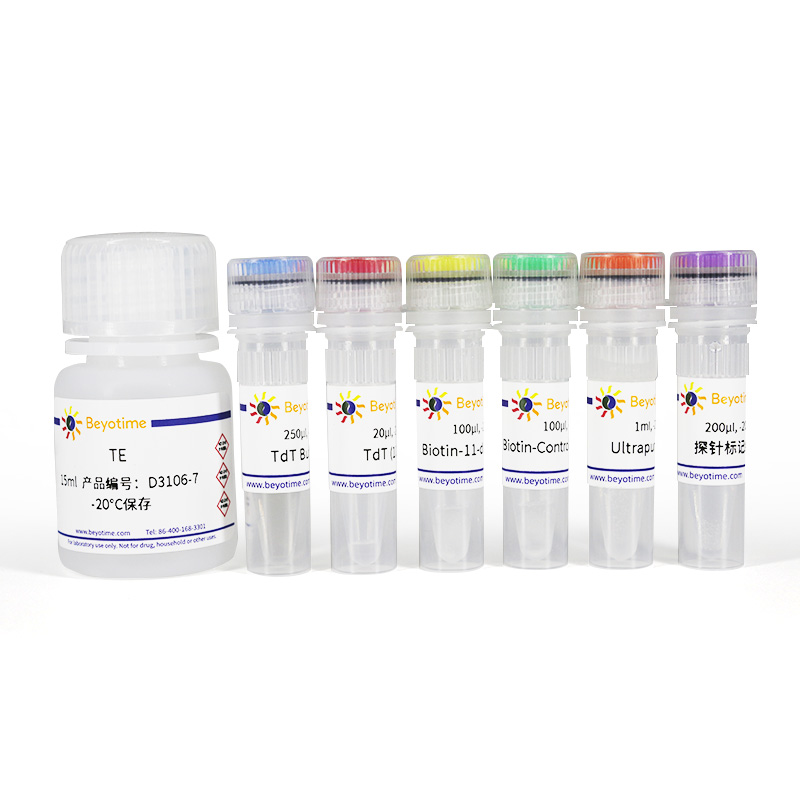
包装清单:
| 产品编号 | 产品名称 | 包装 |
| D3106-1 | TdT Buffer(5X) | 250μl |
| D3106-2 | TdT(10U/μl) | 20μl |
| D3106-3 | Biotin-11-dUTP(5μM) | 100μl |
| D3106-4 | Biotin-Control Oligo(0.4μM) | 100μl |
| D3106-5 | Ultrapure water | 1ml |
| D3106-6 | 探针标记终止液 | 200μl |
| D3106-7 | TE | 15ml |
| — | 说明书 | 1份 |
保存条件:
-20℃保存。
注意事项:
需自备用于检测探针标记效率的带正电荷尼龙膜,以及用于生物素检测的相关试剂。带正电荷尼龙膜(FFN10/FFN11/FFN13/FFN15)可以向碧云天订购。
本产品仅限于专业人员的科学研究用,不得用于临床诊断或治疗,不得用于食品或药品,不得存放于普通住宅内。
为了您的安全和健康,请穿实验服并戴一次性手套操作。
使用说明:
1. 准备工作:
A. 取出TdT Buffer(5X)、Biotin-11-dUTP和Ultrapure water溶解,并置于冰浴上备用。
B. 取出待标记的DNA 探针,用水稀释至1μM,并置于冰浴上备用。
2. DNA探针的标记:
A. 如下设置反应体系:
| Ultrapure water | 29μl |
| TdT Buffer (5X) | 10μl |
| 待标记探针(1μM) | 5μl |
| Biotin-11-dUTP (5μM) | 5μl |
| TdT (10U/μl) | 1μl |
| 总体积 | 50μl |
B. 用枪轻轻吹打混匀,切勿vortex。37℃孵育30分钟。
C. 加入2.5μl探针标记终止液,轻轻混匀终止反应。
3. TdT的去除:
A. 探针标记反应终止后,加入52.5μl氯仿-异戊醇(24:1),vortex使有机相和水相充分混合以抽提TdT(说明:静止后有机相和水相会很快分层)。
B. 12000-14000g离心1-2分钟。吸取上清备用。上清即为被生物素标记的DNA探针。
4. 探针的纯化(选做):
通常为实验简便起见,可以不必纯化标记好的探针。有些时候,纯化后的探针会改善后续实验的结果。如需纯化,可以按照如下步骤操作:
A. 对于100μl标记好的探针,加入1/4体积即25μl的5M醋酸铵,再加入2体积即200μl的无水乙醇,混匀。
B. -70℃至-80℃沉淀1小时,或-20℃沉淀过夜。
C. 4℃,12,000g-16,000g离心30分钟。小心去除上清,切不可触及沉淀。
D. 4℃,12,000g-16,000g离心1分钟。小心吸去残余液体。微晾干沉淀,但不宜过分干燥。
E. 加入50μl TE,完全溶解沉淀。标记好的探针可以-20℃保存。
5. 生物素标记探针标记效率的检测:
A. 取5μl Biotin-Control Oligo(0.4μM),加入196μl TE,混匀,稀释成10nM Biotin-Control Oligo(作为标准品)。取出适量10nM Biotin-Control Oligo,依次稀释成5nM、2.5nM、1nM、0.5nM和0.25nM。
B. 取3μl步骤3B所获得的生物素标记的DNA探针(100nM),加入27μl TE,混匀,稀释成10nM生物素标记的探针(作为待测样品)。取出适量的10nM生物素标记的探针,依次稀释成5nM、2.5nM、1nM、0.5nM和0.25nM。
C. 参考下面的表格,取一适当大小的带正电荷尼龙膜,在膜上做好相应标 记。对于经过梯度稀释的标准品和待测样品,分别取2μl滴加到膜上。在膜上滴加标准品或待测样品时,请注意使液滴充分被膜吸收,在膜上形成一个湿的圆形小斑点。说明:如果条件许可,可 以使用专门用于点杂交或狭缝杂交的设备进行探针标记效率的检测,探针用量也参考下表,浓度 可以稀释50倍,而所用体积可以相应放大50倍至100μl。
| 探针浓度 | 10nM | 5nM | 2.5nM | 1nM | 0.5nM | 0.25nM |
| Biotin-Control Oligo | 2μl | 2μl | 2μl | 2μl | 2μl | 2μl |
| 生物素标记的探针 | 2μl | 2μl | 2μl | 2μl | 2μl | 2μl |
| 探针量 | 20fmol | 10fmol | 5fmol | 2fmol | 1fmol | 0.5fmol |
D. 滴加完所有的标准品和样品后,将膜室温晾干。
E. 用紫外交联仪(UV-light cross-linker)选择254nm紫外波长,120mJ/cm2,交联30-45秒。如果没有紫外交联仪可以使用普通的手提式紫外灯(例如碧云天的手提紫外检测仪,产品编号EUV002),距离膜5-10厘米左右照射1-5分钟。也可以使用超净工作台内的紫外灯,距离膜5-10厘米左右照射1-10分钟。最佳的交联时间可以使用标准品自行摸索。
F. 随后可以立即采用各种生物素检测试剂盒,检测出样品的生物素标记效率;也可以室温存放数天直至进行后续检测。
G. 如果最后采用的是ECL类试剂或其它类似试剂进行检测,则可以对比样品和标准品的灰度,从而计算出探针的标记效率。例如2fmol量的待测样品探针的灰度和1fmol标准品的灰度相同,则说明探针的标记效率大致为50%,待测样品中总探针的浓度约为1μM,而实际被生物素标记的探针约为0.5μM。探针的标记效率也可以通过建立标准曲线进行比较精确的计算。用于后续检测时通常要求标记效率不低于30%。有文献报道标记效率和3'末端的碱基无关,但和整个待标记探针的序列有关。由于在TdT的催化下可以在待标记探针的3'端加上多个Biotin标记的dUTP,因此有时会出现标记效率大于100%的情况。









 微信在线咨询
微信在线咨询