


 微信在线咨询
微信在线咨询

| 产品编号 | 产品名称 | 产品包装 | 产品价格 |
| C2030S | 细菌死活染色试剂盒(DMAO/PI) | 200次 | 352.00元 |
| C2030M | 细菌死活染色试剂盒(DMAO/PI) | 1000次 | 1198.00元 |
碧云天研发生产的细菌死活染色试剂盒(DMAO/PI),即LIVE/DEAD Bacterial Staining Kit with DMAO & PI,或LIVE/DEAD Bacterial Viability Kit with DMAO and PI,也称细菌活力检测试剂盒(Bacterial Viability Assay Kit)或细菌毒性检测试剂盒(Bacterial Cytotoxicity Assay Kit),是一种高效、便捷、灵敏的基于DNA绿色荧光染料DMAO和红色荧光染料碘化丙啶(Propidium iodide, PI)的双荧光染色法检测细菌死活的试剂盒。本试剂盒检测时,活细菌呈现绿色荧光,死细菌呈现绿色和红色两种荧光。本试剂盒可使用荧光显微镜、激光共聚焦显微镜、荧光酶标仪、流式细胞仪等荧光检测系统进行检测。
DMAO,即N, N-dimethylaniline N-oxide,是一种核酸绿色荧光染料,对于革兰氏阳性和阴性细菌均适用,且既能染色活细菌,也能染色死细菌。该染料具有膜通透性,能透过细胞膜,优先结合双链DNA。DMAO非常稳定,在室温下进行常规操作和保存不易降解。PI是一种非渗透性荧光染料,不能穿过具有生物活性的细胞质膜,因此对于具有完整细胞膜的细菌不能染色。而对于坏死细菌,其细胞膜的完整性丧失,PI可进入细胞核并与双链DNA结合,并嵌入细菌的DNA双螺旋形成PI-DNA复合物从而产生红色荧光,这种结合很少或几乎没有序列偏好,每4-5个碱基对插入一分子PI染料[1,2]。将DMAO与PI联合使用检测细菌的死活,具有完整细胞膜的活细菌呈现绿色荧光,细胞膜受损的死细菌同时呈现绿色与红色荧光[3-6]。
DMAO-DNA复合物的最大激发光波长为503nm,最大发射光波长为530nm;PI-DNA复合物的最大激发光波长为535nm,最大发射光波长为617nm。DMAO-DNA和PI-DNA的激发光谱和发射光谱参考图1,可分别使用FITC和Cy3通道观察。
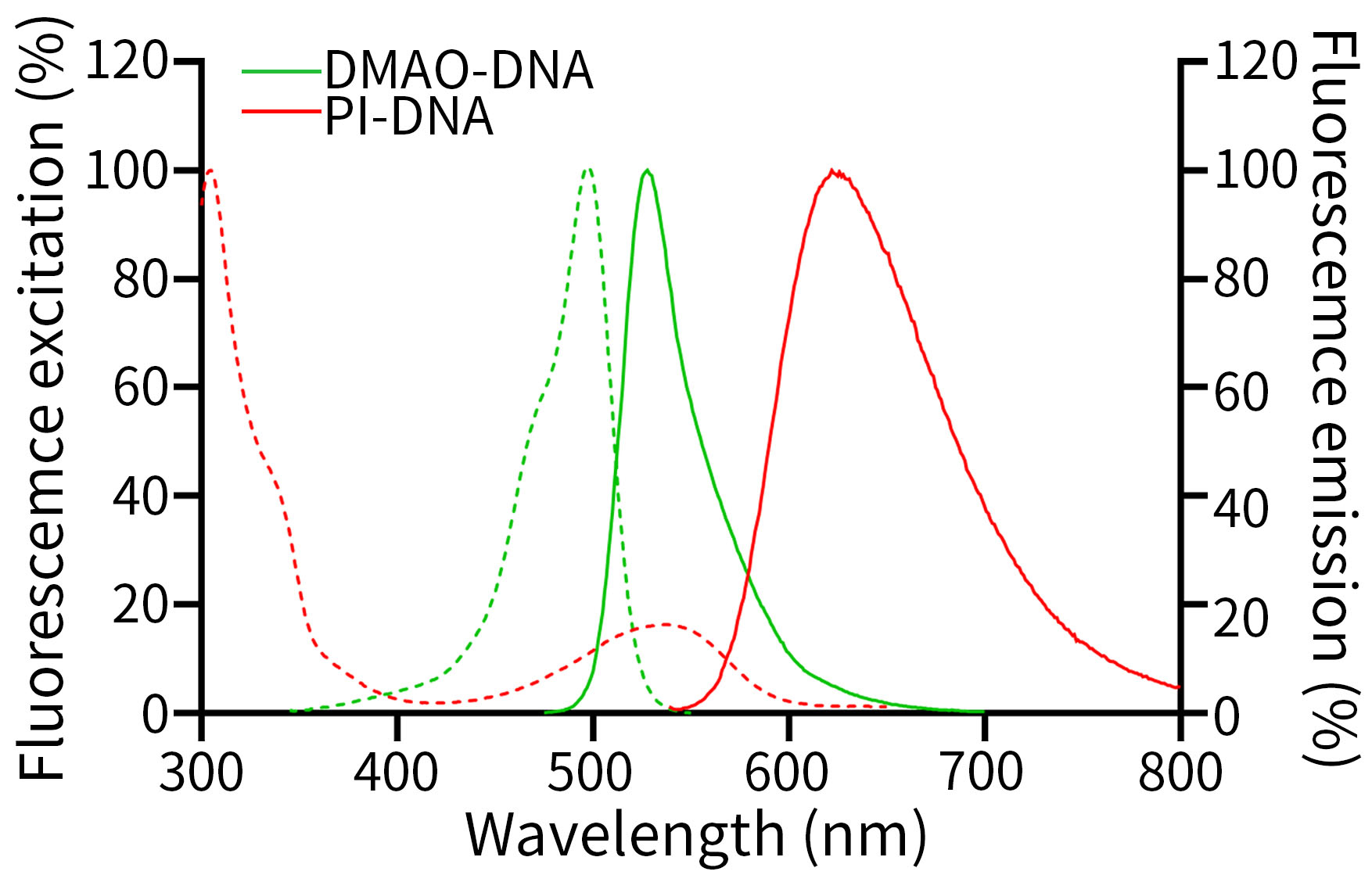
图1.DMAO-DNA和PI-DNA的激发光谱和发射光谱。
本试剂盒提供的DMAO与PI均为1000X的储存液,溶液经过优化,对大多数细菌都适用,但为了获得更满意的结果,对于不同类型的细菌请自行进行一定的浓度摸索,DMAO和PI的使用终浓度一般为0.5-2X,最优先的推荐终浓度为1X。同时,本试剂盒提供检测缓冲液,该缓冲液可用于细菌死活染色工作液的配制。使用本试剂盒检测细菌死活的效果参考图2。

图2.碧云天细菌死活染色试剂盒(DMAO/PI) (C2030)对大肠杆菌DH5α菌株染色的效果图。DMAO和PI双染叠加(Merge)后可以非常清晰地观察到活细菌和死细菌的荧光染色差别。死细菌组(Dead Bacteria Group)即Dead Bacteria Ratio为~100%组,红绿荧光染色数目基本一致,两种荧光几乎完全重合,叠加后呈黄色;活细菌与死细菌混合组(Live/Dead Bacteria Group)即Dead Bacteria Ratio为~30%组,两种荧光叠加后,活细菌呈绿色,死细菌呈黄色;活细菌组(Live Bacteria Group)即Dead Bacteria Ratio为~5%组,两种荧光叠加后,可见基本为绿色荧光,黄色荧光基本不见或仅个别可见。实际检测效果会因实验条件、染料浓度、细菌种类、检测仪器等的不同而存在差异,图中效果仅供参考。
本试剂盒使用荧光酶标仪检测细菌死活标准品的效果参考图3,在0-100%的细菌存活率范围内有良好的线性关系。
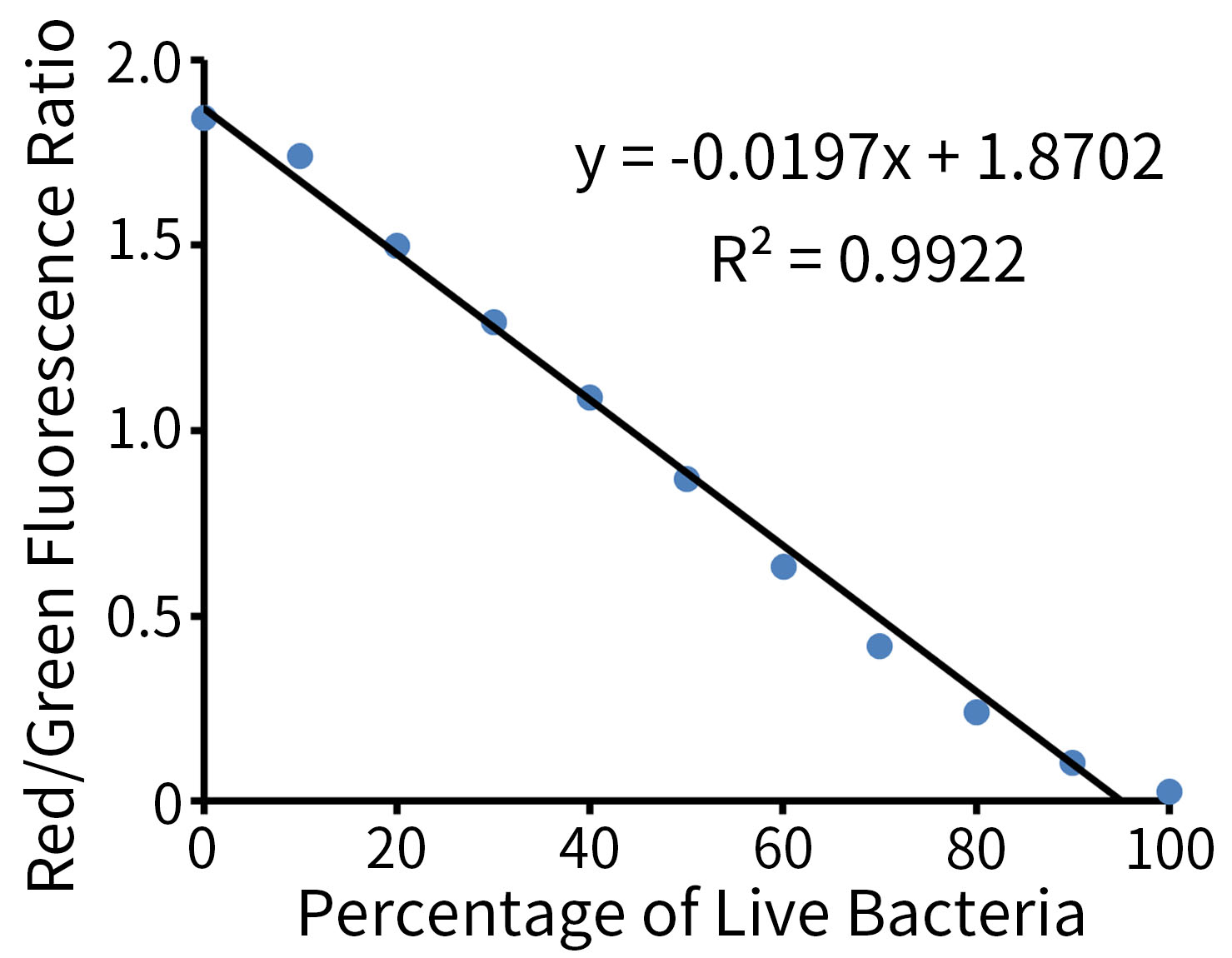
图3.碧云天细菌死活染色试剂盒(DMAO/PI) (C2030)对不同细菌死活比例DH5α菌株的检测效果。活细菌占比越高,红色荧光越少,红绿比值越低。实际检测数据会因实验条件、染料浓度、细菌种类、检测仪器等的不同而存在差异,图中数据仅供参考。
本试剂盒小包装和中包装用于荧光显微镜或荧光酶标仪检测时,可以分别进行200次和1000次的检测。
包装清单:| 产品编号 | 产品名称 | 包装 |
| C2030S-1 | DMAO (1000X) | 20µl |
| C2030S-2 | PI (1000X) | 20µl |
| C2030S-3 | 检测缓冲液 | 1ml |
| — | 说明书 | 1份 |
| 产品编号 | 产品名称 | 包装 |
| C2030M-1 | DMAO (1000X) | 100µl |
| C2030M-2 | PI (1000X) | 100µl |
| C2030M-3 | 检测缓冲液 | 5ml |
| — | 说明书 | 1份 |
-20ºC保存,一年有效。其中DMAO (1000X)和PI (1000X)须避光保存。
注意事项:细菌染色前应去除培养基,培养基内的组分会结合DMAO与PI染料,使染色效率降低。
荧光染料均存在淬灭问题,请尽量注意避光,以减缓荧光淬灭。
初次使用时DMAO (1000X)和PI (1000X)可适当分装后-20ºC保存,以避免反复冻融。
检测缓冲液经过过滤除菌处理,在使用时须注意避免微生物污染,否则很可能严重影响染色效果。如果检测缓冲液发生浑浊等明显的微生物污染,就不能继续使用。
荧光酶标仪检测时须使用适合荧光检测的黑板或白板,推荐使用碧云天BeyoGold™全黑96孔细胞培养板(平底带盖, 独立包装) (FCP966)或BeyoGold™黑色透明底96孔细胞培养板(平底带盖, 独立包装) (FCP965)。
本产品仅限于专业人员的科学研究用,不得用于临床诊断或治疗,不得用于食品或药品,不得存放于普通住宅内。
为了您的安全和健康,请穿实验服并戴一次性手套操作。
| Well Number | Percentage of Live Bacteria (%) | Volume of Live Bacteria (μl) | Volume of Dead Bacteria (μl) |
| 1 | 0 | 0 | 100 |
| 2 | 10 | 10 | 90 |
| 3 | 20 | 20 | 80 |
| 4 | 30 | 30 | 70 |
| 5 | 40 | 40 | 60 |
| 6 | 50 | 50 | 50 |
| 7 | 60 | 60 | 40 |
| 8 | 70 | 70 | 30 |
| 9 | 80 | 80 | 20 |
| 10 | 90 | 90 | 10 |
| 产品编号 | 产品名称 | 包装 |
| C0052S | BacTiter-Lumi™发光法微生物细胞活力检测试剂盒 | 100次 |
| C0052M | BacTiter-Lumi™发光法微生物细胞活力检测试剂盒 | 500次 |
| C0052L | BacTiter-Lumi™发光法微生物细胞活力检测试剂盒 | 2500次 |
| C0053S | BacTiter-Lumi™ Plus发光法微生物细胞活力检测试剂盒 | 100次 |
| C0053M | BacTiter-Lumi™ Plus发光法微生物细胞活力检测试剂盒 | 500次 |
| C0053L | BacTiter-Lumi™ Plus发光法微生物细胞活力检测试剂盒 | 2500次 |
| C2015S | Calcein/PI细胞活性与细胞毒性检测试剂盒 | 100次 |
| C2015M | Calcein/PI细胞活性与细胞毒性检测试剂盒 | 500次 |
| C2015L | Calcein/PI细胞活性与细胞毒性检测试剂盒 | 2500次 |
| C2030S | 细菌死活染色试剂盒(DMAO/PI) | 200次 |
| C2030M | 细菌死活染色试剂盒(DMAO/PI) | 1000次 |
| RG039S | Bac-Lumi™细菌萤火虫萤光素酶检测试剂 | 100次 |
| RG039M | Bac-Lumi™细菌萤火虫萤光素酶检测试剂 | 1000次 |
| ST341-500ml | 生理盐水(0.9% NaCl, 无菌) | 500ml |









 微信在线咨询
微信在线咨询












