微信在线咨询
微信在线咨询

| 产品编号 | 产品名称 | 产品包装 | 产品价格 |
| C2003S | 增强型线粒体膜电位检测试剂盒(JC-1) | >100次 | 1138.00元 |
增强型线粒体膜电位检测试剂盒(JC-1) (Enhanced mitochondrial membrane potential assay kit with JC-1)是一种以JC-1为荧光探针,快速灵敏地检测细胞、组织或纯化的线粒体膜电位变化的试剂盒,可以用于早期的细胞凋亡检测。本产品经优化处理,极大提高了JC-1在水溶液中的溶解性,增强了染色效果。
JC-1是一种广泛用于检测线粒体膜电位(mitochondrial membrane potential) ∆Ψm的理想荧光探针。可以检测细胞、组织或纯化的线粒体膜电位。在线粒体膜电位较高时,JC-1聚集在线粒体的基质(matrix)中,形成聚合物(J-aggregates),可以产生红色荧光;在线粒体膜电位较低时,JC-1不能聚集在线粒体的基质中,此时JC-1为单体(monomer),可以产生绿色荧光。这样就可以非常方便地通过荧光颜色的转变来检测线粒体膜电位的变化。常用红绿荧光的相对比例来衡量线粒体去极化的比例。
线粒体膜电位的下降是细胞凋亡早期的一个标志性事件。通过JC-1从红色荧光到绿色荧光的转变可以很容易地检测到细胞膜电位的下降,同时也可以用JC-1从红色荧光到绿色荧光的转变作为细胞凋亡早期的一个检测指标。JC-1检测线粒体膜电位的效果参考图1。
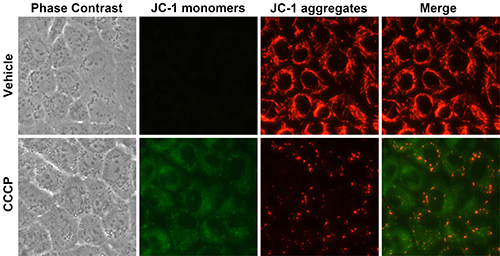
图1. 本试剂盒检测NRK-52E细胞(大鼠肾小管上皮细胞)线粒体膜电位的效果图。正常的NRK-52E细胞线粒体中JC-1以聚合物形式存在,呈明亮的红色荧光,绿色荧光很弱;使用CCCP诱导使线粒体膜电位下降后,JC-1便不能以聚合物形式存在线粒体内膜中,因此线粒体内红色荧光强度显著降低,而绿色荧光显著增强。
JC-1单体的最大激发波长为514nm,最大发射波长为529nm;JC-1聚合物(J-aggregates)的最大激发波长为585nm,最大发射波长为590nm。实际观察时,使用常规的观察红色荧光和绿色荧光的设置即可。JC-1单体和聚合物的激发光和发射光光谱参考图2。
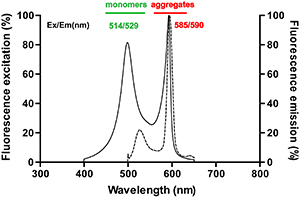
图2. JC-1单体和聚合物的激发光和发射光光谱。
本试剂盒提供了CCCP作为诱导线粒体膜电位下降的阳性对照。
本产品经优化处理,极大提高了JC-1在溶液中的溶解性,可以直接使用染色缓冲液进行配制,轻轻吹打混匀即可用于细胞的荧光染色,大大缩短实验时间,并能增强染色效果。
碧云天各种线粒体膜电位检测试剂盒的比较和选择,请参考:
https://www.beyotime.com/support/MitochondrialMembrane.htm。
对于6孔板中的样品,按照每孔使用1ml JC-1染色工作液计算,本试剂盒共可以检测100个样品;对于12孔板中的样品,按照每孔使用500μl JC-1染色工作液计算,本试剂盒共可以检测200个样品。
包装清单:| 产品编号 | 产品名称 | 包装 |
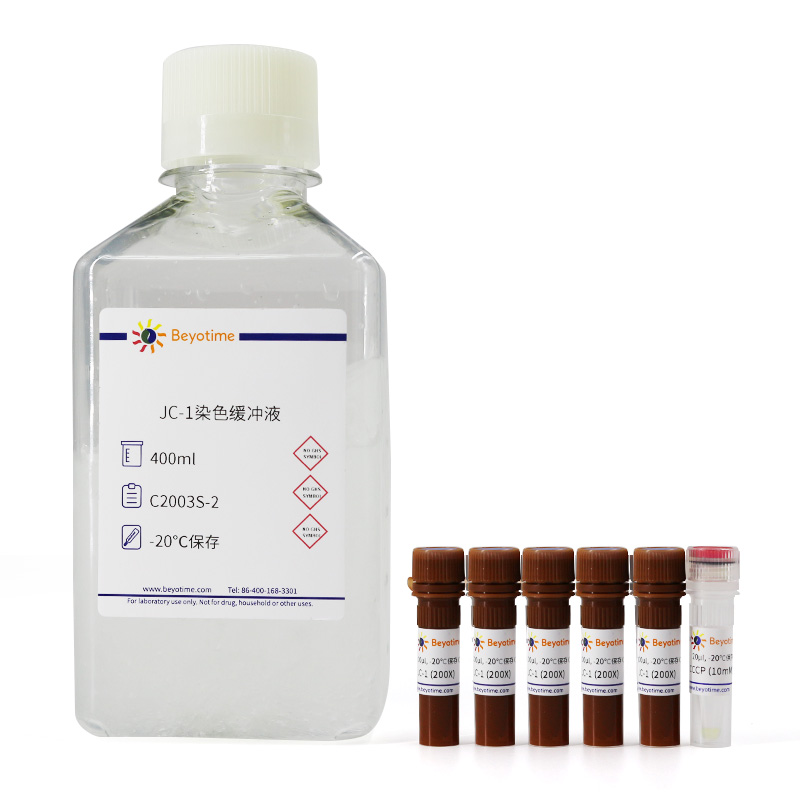
| C2003S-1 | JC-1 (200X) | 100µl/管,共5管 |
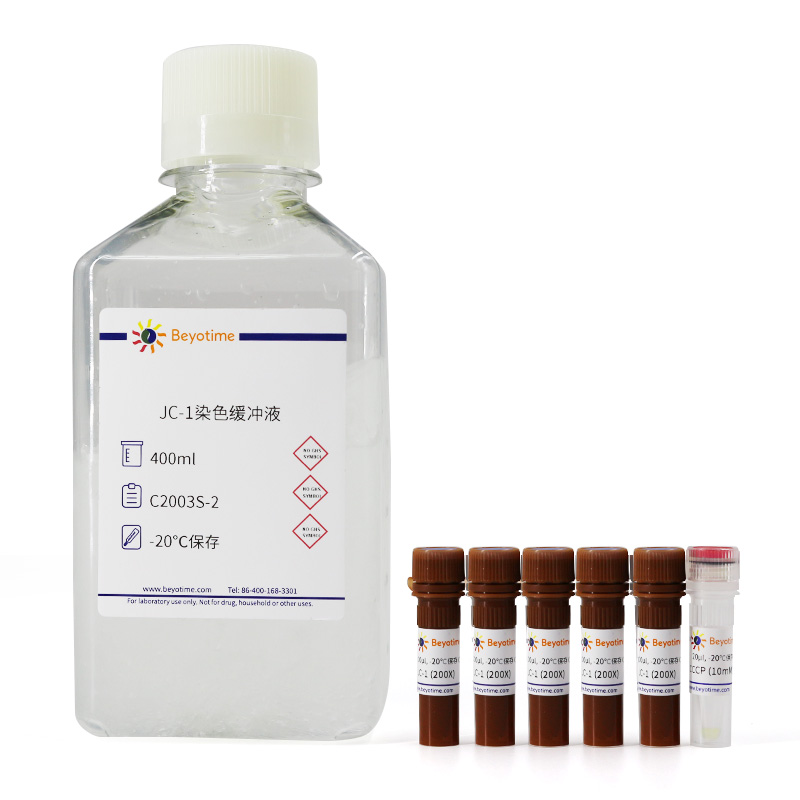
| C2003S-2 | JC-1染色缓冲液 | 400ml |
| C2003S-3 | CCCP (10mM) | 20μl |
| - | 说明书 | 1份 |
-20℃保存。JC-1 (200X)需避光保存,并尽量避免反复冻融。JC-1染色缓冲液4℃保存,至少2周内有效。
注意事项:JC-1 (200X)在4℃、冰浴等较低温度情况下会凝固而粘在离心管管底、管壁或管盖内,可以20-25℃水浴温育片刻至全部融解后使用。
JC-1探针装载完并洗涤后尽量在30分钟内完成后续检测。在检测前需冰浴保存。
JC-1染色缓冲液须在无菌环境中使用,如有微生物污染可能会严重影响染色效果。
洗涤时也可以用Hanks' Balanced Salt Solution (with Ca2+ & Mg2+) (C0219)、PBS等替代JC-1染色缓冲液。
CCCP为线粒体电子传递链抑制剂,对人体有害,操作时请小心,并注意有效防护以避免直接接触人体或吸入体内。
本产品仅限于专业人员的科学研究用,不得用于临床诊断或治疗,不得用于食品或药品,不得存放于普通住宅内。
为了您的安全和健康,请穿实验服并戴一次性手套操作。
| 产品编号 | 产品名称 | 包装 |
| C1002 | DAPI | 5mg/ml×0.2ml |
| C1005/C1006 | DAPI染色液 | 10ml/50ml |
| C1011 | Hoechst 33258 | 10mg |
| C1017/C1018 | Hoechst 33258染色液 | 10ml/50ml |
| C1022 | Hoechst 33342 | 10mg |
| C1025/C1026 | Hoechst 33342染色液 | 10ml/50ml |
| C1027/C1028/C1029 | Hoechst 33342活细胞染色液(100X) | 0.1ml/0.5ml/3ml |
| C1031 | CFDA SE (细胞增殖示踪荧光探针) | 5mg |
| C1033 | Actin-Tracker Green (微丝绿色荧光探针) | 0.2ml |
| C1036 | DiI (细胞膜红色荧光探针) | 10mg |
| C1038 | DiO (细胞膜绿色荧光探针) | 10mg |
| C1041 | ER-Tracker Red (内质网红色荧光探针) | 20μl |
| C1043 | Golgi-Tracker Red (高尔基体红色荧光探针) | 1mg |
| C1046 | Lyso-Tracker Red (溶酶体红色荧光探针) | 50μl |
| C1048 | Mito-Tracker Green (线粒体绿色荧光探针) | 50μg |
| C1050 | Tubulin-Tracker Red (抗体法微管红色荧光探针) | 40μl |
| C2003S | 增强型线粒体膜电位检测试剂盒(JC-1) | >100次 |
| C2005 | JC-1 | 1mg |
| C2006 | 线粒体膜电位检测试剂盒(JC-1) | >100次 |
| C2007 | Rhodamine 123 | 5mg |
| S0019 | DAF-FM DA (NO荧光探针) | >100次 |
| S0063 | Dihydroethidium (超氧化物阴离子荧光探针) | 5mg |
| S1006 | BCECF AM (pH荧光探针, 5mM) | 50微升 |
| S1052 | Fura-2 AM (钙离子荧光探针, 2mM) | 50微升 |
| S1056 | Fluo-3 AM (钙离子荧光探针, 5mM) | 20微升 |
| S1060 | Fluo-4 AM (钙离子荧光探针, 2mM) | 25微升 |
| S1082 | MQAE (氯离子荧光探针) | 20mg |









 微信在线咨询
微信在线咨询