微信在线咨询
微信在线咨询

| 产品编号 | 产品名称 | 产品包装 | 产品价格 |
| C2041S | 彗星电泳试剂盒 | 20次 | 378.00元 |
| C2041M | 彗星电泳试剂盒 | 100次 | 998.00元 |
碧云天生产的彗星电泳试剂盒(Comet Assay Kit),也称彗星检测试剂盒、彗星电泳检测试剂盒、彗星电泳DNA损伤检测试剂盒(DNA Damage Comet Assay Kit),是一种简单、快速、高效的通过电泳检测单细胞DNA损伤的试剂盒。彗星电泳实验也被称为单细胞凝胶电泳检测(Single Cell Gel Electrophoresis Assay, SCGE),是一种快速检测单细胞DNA损伤的实验方法,因在电泳时观察到的DNA受损细胞形似彗星的图像,故称彗星电泳或彗星试验[1]。
常见的DNA损伤有碱基修饰、DNA链内和链间交联、DNA单链断裂(Single strand-breaks, SSBs)以及DNA双链断裂(Double-strand breaks, DSBs)等,其中DSBs被认为是最严重的DNA损伤。引起DNA产生DSBs的物理或化学因素有紫外线照射、电离辐射(X、γ射线等)、遗传毒性化学物质和化疗药物等。DSBs的无效修复或错误修复可以引发基因组紊乱,最终导致肿瘤及其它相关疾病的发生[2]。
根据DNA损伤的原理,DNA的损伤检测可以分为三类:基于损伤DNA理化性质的改变,如彗星实验;基于分子杂交,如荧光原位杂交法(Fluorescence in situ hybridization, FISH);基于DNA损伤后形成的产物检测DNA损伤,如检测磷酸化的H2AX、暴露的3'-OH (TUNEL检测)和8-OHdG等。前两种方法是基于荧光标记直接观测DNA的损伤情况,而基于DNA损伤后形成产物检测DNA损伤是通过标记物间接反映DNA的损伤程度。本彗星电泳试剂盒基于荧光标记直接检测DNA的损伤情况,最初由Östling和Johansson在1984年发明,此后由Singh等在1988年改进,此后成为评估DNA损伤与修复、遗传毒性检测常用的标准实验技术[3-6]。
彗星电泳是一种检测真核细胞DNA损伤的常用方法,其检测原理如下。低熔点琼脂糖凝胶具有在37℃下保持溶液状态的特点,可保持细胞的原有状态,不会造成额外的DNA损伤,避免了正常熔点琼脂糖需要更高温度熔解而导致的细胞损伤。因此将细胞包埋在含有低熔点琼脂糖凝胶的载玻片上,细胞经裂解后,正常细胞细胞核中的大分子DNA由于其完整性,在电场作用下迁移速率基本一致,DNA荧光染色仍然能保持细胞核的形态或有非常轻微的拖尾;如果DNA发生单链或双链断裂,在电场作用下,不同分子量的DNA呈现不同的迁移速率,大分子DNA迁移速率较低,而小分子DNA片段迁移速率较快,荧光染色后,大分子DNA仍然呈现细胞核样的形态,形似彗星的头部(Comet head),小分子DNA呈现逸出细胞核的拖尾形态,形似彗星的尾巴(Comet tail)。DNA损伤越严重,小分子DNA片段就越多并且片段越小,电泳时的迁移速率越快,彗星状拖尾就越长。因此,通过测定彗尾部分的光密度或长度就可定量测定单个细胞DNA损伤程度[6]。使用本试剂盒检测HeLa细胞中DNA损伤的效果参考图1。

图1.碧云天彗星电泳试剂盒(C2041)检测HeLa细胞中DNA损伤的效果图。正常培养条件下的HeLa细胞中(Control),几乎没有彗星状拖尾,说明DNA很完整;在25μM或50μM Camptothecin (SC0141)诱导1小时后,部分细胞核出现明显的彗尾,说明DNA出现不同程度的损伤。实际染色效果会因实验条件、检测仪器等的不同而存在差异,图中效果仅供参考。
根据裂解液的差异,彗星电泳可以分为中性彗星电泳和碱性彗星电泳。中性彗星电泳,主要用于检测DNA双链的断裂;碱性彗星电泳,灵敏度更高,可以检测更少量的单双链断裂、DNA的碱性不稳定位点及不完整切除修复引起的DNA链的断裂等。本试剂盒采用了常用的碱性彗星电泳法。
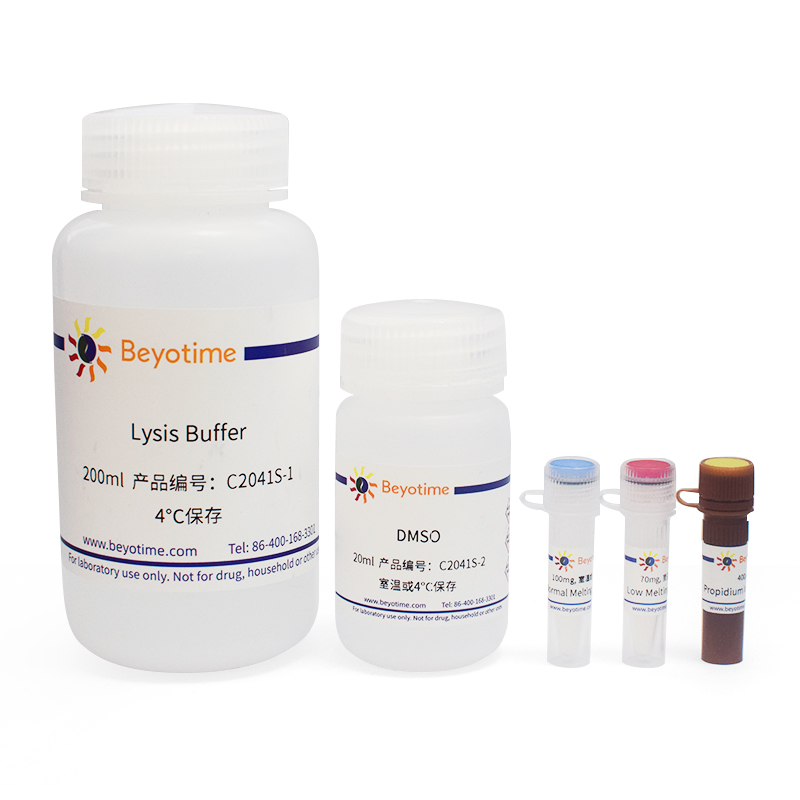
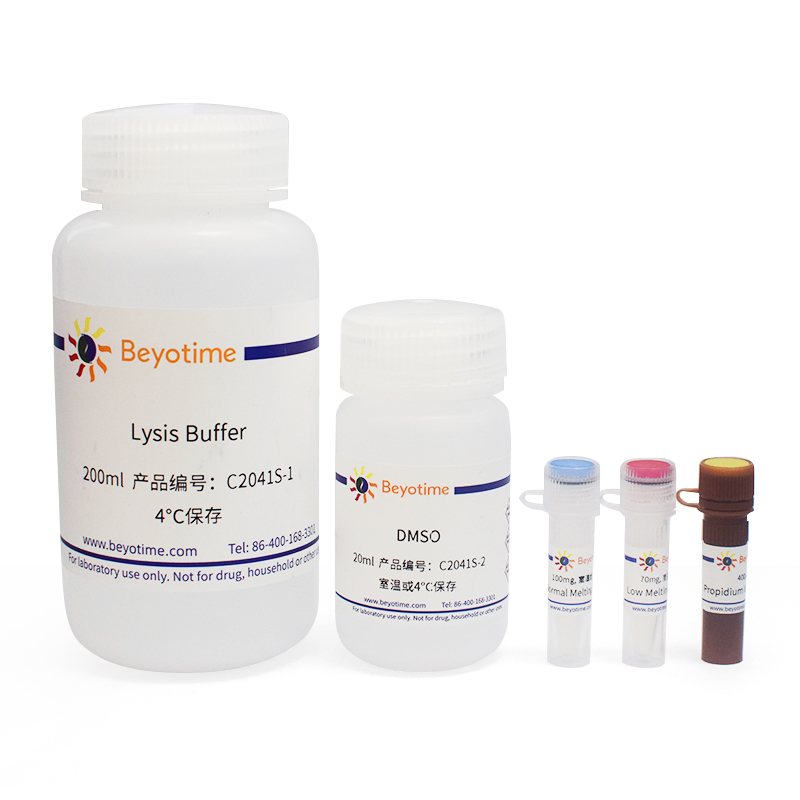
本试剂盒小包装可以检测20个样品,中包装可以检测100个样品。
包装清单:| 产品编号 | 产品名称 | 包装 |
| C2041S-1 | Lysis Buffer | 200ml |
| C2041S-2 | DMSO | 20ml |
| C2041S-3 | Normal Melting Point Agarose | 100mg |
| C2041S-4 | Low Melting Point Agarose | 70mg |
| C2041S-5 | Propidium Iodide Solution | 400μl |
| - | 说明书 | 1份 |
| 产品编号 | 产品名称 | 包装 |
| C2041M-1 | Lysis Buffer | 500ml×2 |
| C2041M-2 | DMSO | 100ml |
| C2041M-3 | Normal Melting Point Agarose | 500mg |
| C2041M-4 | Low Melting Point Agarose | 350mg |
| C2041M-5 | Propidium Iodide Solution | 2ml |
| - | 说明书 | 1份 |
4℃保存,一年有效。其中Propidium Iodide Solution须避光保存。DMSO、Normal Melting Point Agarose、Low Melting Point Agarose也可室温保存。
注意事项:Lysis Buffer必须完全溶解后再使用,如有沉淀,可37℃水浴充分溶解。
从细胞裂解步骤开始,所有的试剂均应提前在4℃预冷后用于细胞,并在裂解、解旋、电泳、中和过程中保持4℃低温状态及避光,防止诱发额外的DNA损伤。重点注意避免日光、日光灯等中的紫外线对DNA的损伤。
需使用不含钙、镁离子的PBS,推荐使用碧云天的PBS (C0221A)。
DNA损伤的阳性对照可通过一定浓度的Camptothecin (SC0141)、Cisplatin (S1552)和Etoposide (SC0173)等进行诱导,具体可参考碧云天的DNA损伤检测试剂盒(γ-H2AX免疫荧光法) (C2035),也可以使用100μM过氧化氢或25μM KMnO4在4℃处理20分钟。
本试剂盒中Propidium Iodide Solution对人体有害,操作时请小心,并注意有效防护以避免直接接触人体或吸入体内。
本产品仅限于专业人员的科学研究用,不得用于临床诊断或治疗,不得用于食品或药品,不得存放于普通住宅内。
为了您的安全和健康,请穿实验服并戴一次性手套操作。
| Reagent | Volume |
| NaOH | 4g |
| 0.5M EDTA (ST066) | 1ml |
| Ultrapure Water | 499ml |
| Total Volume | 500ml |
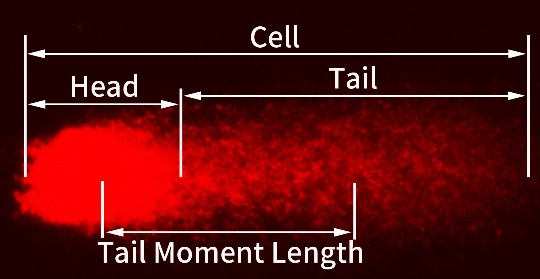 图2.彗星电泳中细胞DNA损伤的尾矩。
c.DNA损伤判定:每个样品随机选择50-100个细胞,测定相应指标。DNA损伤按尾部DNA百分比的比例分为5级,可使用:
图2.彗星电泳中细胞DNA损伤的尾矩。
c.DNA损伤判定:每个样品随机选择50-100个细胞,测定相应指标。DNA损伤按尾部DNA百分比的比例分为5级,可使用:| 产品编号 | 产品名称 | 包装 |
| C0007 | 细胞凋亡-DNA Ladder抽提试剂盒 | 50次 |
| C1091 | TUNEL细胞凋亡检测试剂盒(显色法) | 20次 |
| C1098 | TUNEL细胞凋亡检测试剂盒(显色法) | 50次 |
| C1089 | 一步法TUNEL细胞凋亡检测试剂盒(红色荧光) | 20次 |
| C1090 | 一步法TUNEL细胞凋亡检测试剂盒(红色荧光) | 50次 |
| C1086 | 一步法TUNEL细胞凋亡检测试剂盒(绿色荧光) | 20次 |
| C1088 | 一步法TUNEL细胞凋亡检测试剂盒(绿色荧光) | 50次 |
| C2035S | DNA损伤检测试剂盒(γ-H2AX免疫荧光法) | >100次 |
| C2041S | 彗星电泳试剂盒 | 20次 |
| C2041M | 彗星电泳试剂盒 | 100次 |
| FSL061-5pcs | 彗星电泳载玻片(2孔) | 5片/盒 |
| FSL061-25pcs | 彗星电泳载玻片(2孔) | 5片/盒, 5盒/箱 |









 微信在线咨询
微信在线咨询