微信在线咨询
微信在线咨询

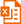
| 产品编号 | 产品名称 | 产品包装 | 产品价格 |
| S0179 | NADP+/NADPH检测试剂盒(WST-8法) | 100次 | 1436.00元 |
碧云天的NADP+/NADPH检测试剂盒(WST-8法) (NADP+/NADPH Assay Kit with WST-8)是一种基于WST-8的显色反应,通过比色法来检测细胞、组织或其它样品中NADP+ (氧化型辅酶II)和NADPH (还原型辅酶II)各自的量、比值和总量的检测试剂盒。
NADP+/NADPH以及NAD+/NADH的传统检测方法是检测NADPH或者NADH在340nm处吸收波长的变化,该方法灵敏度较低并易受样品中有类似紫外吸收物质的干扰,并且在紫外检测过程中通常需要加大检测样品量以弥补NADPH在340nm处吸光度过小的不足,因此该检测方法具有很大的局限性。
WST-8是MTT的一种升级替代产品,和MTT或其它MTT类似产品如XTT、MTS等相比有明显的优点。首先,MTT被一些脱氢酶还原生成的formazan不是水溶性的,需要有特定的溶液来溶解;而WST-8和XTT、MTS产生的formazan都是水溶性的,可以省去后续的溶解步骤。其次,WST-8产生的formazan比XTT和MTS产生的formazan更易溶解。再次,WST-8比XTT和MTS更加稳定,使实验结果更加稳定。另外,WST-8和MTT、XTT等相比,线性范围更宽,灵敏度更高。
WST-8和WST-1相比,检测灵敏度更高,更易溶解,并且更加稳定。
本试剂盒使用便捷,无需分离纯化细胞、组织或其它样品中的NADP+和NADPH,且特异性检测NADP+和NADPH,而不检测NAD+和NADH。本试剂盒可以检测含量低至0.05μM (2.5pmol)的NADP+或NADPH,在0.05μM (2.5pmol)至6μM (300pmol)之间呈现良好的线性关系。
NADP (Nicotinamide adenine dinucleotide phosphate,烟酰胺腺嘌呤二核苷酸磷酸)是很多氧化还原反应的辅酶,包括NADP+ (氧化型)和NADPH (还原型)两种形式。NADP+也参与到生物合成反应中,比如脂质和核酸的合成。在动物细胞中,戊糖磷酸途径(pentose phosphate pathway,PPP)的氧化阶段是NADPH最主要的来源。
本试剂盒可检测样品中的NADP+、NADPH以及它们的比值,具体原理如下:

本试剂盒适用于检测细胞、组织以及其它适当样品中的NADP+和NADPH各自的量、比值和总量。
本试剂盒提供的NADP+/NADPH提取液有一定的通用性。使用本试剂盒中的NADP+/NADPH提取液提取获得的细胞或组织样品,也可以用于碧云天生产的NAD+/NADH检测试剂盒(WST-8法) (S0175)的检测。
当仅检测NADP+和NADPH的总量或者样品中的NADPH的量时,一个本试剂盒可以进行100次检测;当检测NADP+或者NADP+/NADPH的比值时,一个本试剂盒可以进行50次检测。
包装清单:
| 产品编号 | 产品名称 | 包装 |
| S0179-1 | G6PDH | 220μl |
| S0179-2 | 显色液 | 1.1ml |
| S0179-3 | NADPH | 5mg |
| S0179-4 | NADP+/NADPH提取液 | 50ml |
| S0179-5 | 反应缓冲液 | 11ml |
| — | 说明书 | 1份 |
保存条件:
-20℃保存,一年有效。显色液(S0179-2)和NADPH (S0179-3)须-20℃避光保存。NADPH配制成溶液后,须适当分装后-80℃保存。所有试剂避免反复冻融。
注意事项:
本试剂盒中的所有试剂均需要冷冻保存,请严格按照保存条件进行保存。如果不是一次用完,为避免反复冻融导致产品失效,请适当分装后保存。
NADPH不太稳定,取出NADPH后请尽快使用。如果发现标准曲线不理想,很有可能是标准品发生了降解。
由于NADP+/NADPH提取液本身比较粘稠,以该提取液作为稀释液时,无论对标准品还是样品进行稀释,在稀释过程中务必保证稀释均匀,否则易造成实验数据产生较大波动。
细胞或组织样品的提取,请严格按照每100万个细胞或10mg组织加入200μl提取液的比例加入NADP+/NADPH提取液。如果提取液用量过少,得到的样品提取液可能会出现比较粘稠、不易吸取的情况,影响实验操作的便利性,进而影响检测结果的准确性。推荐使用增强型NADP+/NADPH检测试剂盒(WST-8法) (S0180),可有效解决在提取细胞和组织样品时可能出现的粘稠问题。
在样品加样和混匀过程中,须尽量避免产生气泡,以免影响最终的吸光度测定。
如果不能非常严格地控制反应温度和反应时间,每次检测都需要设置标准曲线。
如果样品溶液中NADP+和NADPH浓度过高或过低,不在试剂盒的线性检测范围内时,可适当调整样品或者提取液的用量。
由于NADP+和NADPH很不稳定,在冻存过程中较易降解,所以宜尽量使用新鲜样品进行检测。如果需要进行样品中NADP+以及NADP+/NADPH比值的测定,在样品加热30分钟以分解NADP+的过程中,可以先进行样品中NADP+和NADPH的总量的测定,即将NADP+和NADPH的总量的测定和单独NADPH的测定分开进行,尽量减少样品在等待过程中因为可能的降解导致的误差。本试剂盒中的所有试剂均需要冷冻保存,请严格按照保存条件进行保存。如果不是一次用完,为避免反复冻融导致产品失效,请适当分装后保存。
本产品仅限于专业人员的科学研究用,不得用于临床诊断或治疗,不得用于食品或药品,不得存放于普通住宅内。
为了您的安全和健康,请穿实验服并戴一次性手套操作。
使用说明:
1. 样品的准备:
a.细胞样品的准备:对于贴壁细胞,约1×106个细胞(大约相当于6孔板一个孔长满的细胞数量),吸净培养液,按照每100万个细胞加入200μl提取液的比例用移液器加入200μl的NADP+/NADPH提取液,并轻轻吹打,以促进细胞的裂解;对于悬浮细胞,约1×106个细胞,600×g离心5分钟,吸净培养液,按照每100万个细胞加入200μl提取液的比例用移液器加入200μl冰浴预冷的NADP+/NADPH提取液,并轻轻吹打,以促进细胞的裂解;裂解过程在室温或冰上操作均可。随后12,000×g,4ºC离心5-10分钟,取上清作为待测样品备用。
b.组织样品的准备:冰上预冷的PBS洗涤组织后,称取约10-30mg的组织样品,用剪刀剪碎,置于匀浆器中,按照每10mg组织加入200μl提取液的比例加入200-600μl的NADP+/NADPH提取液在室温或冰上进行匀浆。随后12,000×g,4ºC离心5-10分钟,取上清作为待测样品备用。
注:细胞或组织裂解得到的样品提取液中含有一些酶,可能会消耗NADPH。如果希望获得更加理想的检测结果,建议裂解后用超滤管(10kDa)(FUF051)超滤离心,收集超滤后的样品用于后续测试。细胞或组织量较大、提取液用量较少时,得到的样品提取液可能会较为粘稠,导致吸取不便,请严格按照每100万个细胞或10mg组织加入200μl提取液的比例加入NADP+/NADPH提取液进行细胞或组织样品的提取,只要吹打均匀,通常情况下不会出现不便吸取的情况。推荐使用增强型NADP+/NADPH检测试剂盒(WST-8法) (S0180),可有效解决在提取细胞和组织样品时可能出现的粘稠问题。
2. 试剂盒的准备工作:
a. NADPH标准品的配制:吸取6ml超纯水充分溶解本试剂盒提供的5mg NADPH后即得到1mM NADPH标准品。1mM NADPH标准品请适当分装后-80℃避光保存。
b. NADPH标准曲线的设置:把1mM的NADPH标准品用NADP+/NADPH提取液稀释成适当的浓度梯度,如初次检测可以设置0、0.25、0.5、1、2、4μM这几个浓度,检测时96孔板每孔加入50μl的标准品,相当于每孔为0、12.5、25、50、100、200pmol的NADPH。如有必要,在后续的实验中可以根据样品中的NADPH含量对标准品的浓度范围进行适当调整。其中浓度为0μM的点为空白对照点,仅含NADP+/NADPH提取液。注意:由于NADPH很不稳定,故配制后需尽快使用。
c. G6PDH工作液的配制:将G6PDH用反应缓冲液稀释50倍,例如2μl G6PDH加入到98μl的反应缓冲液中,即可获得100μl的G6PDH工作液。每个标准品或样品的检测需要使用100μl的G6PDH工作液,请根据所需检测的标准品和样品的数量,配制适量的G6PDH工作液,并注意现配现用。
3. 样品测定:
a.样品中NADP+和NADPH总量的测定:吸取50μl用NADP+/NADPH提取液稀释后的待测样品至96孔板中,为了减少实验误差请设置样品的重复孔。
注:为获得理想的检测效果,建议将细胞样品稀释2-10倍、组织样品稀释5-50倍后进行测定,也可以同时设定多个稀释倍数。后续如果发现样品中的NADP+和NADPH的总量过高,超出标准曲线的范围,则需要加大样品的稀释倍数;总量过低时则需要加大细胞或组织样品的用量或者降低样品的稀释倍数。
b.样品中NADP+、NADPH的含量或者NADP+/NADPH比值的测定:吸取100-200μl待测样品于离心管中,60ºC水浴或PCR仪上加热30分钟以分解NADP+。剩余样品可4ºC保存,样品检测前都需要平衡至室温。如果加热后产生不溶物,则需10,000×g,室温或4ºC离心5分钟,吸取50μl用NADP+/NADPH提取液稀释后的上清液作为待测样品至96孔板中,为了减少实验误差建议设置样品的重复孔。
注:为获得理想的检测效果,建议将细胞样品稀释2-10倍、组织样品稀释5-50倍后进行测定,也可以同时设定多个稀释倍数。后续如果发现样品中的NADP+或NADPH的含量过高,超出标准曲线的范围,则需要加大样品的稀释倍数;含量过低时则需要加大细胞或组织样品的用量或者降低样品的稀释倍数。
c. 请参考下表使用96孔板设置空白对照孔、标准品孔和样品孔。加入G6PDH工作液后充分混匀。
| 空白对照(Blank) | 标准品(Standard) | 样品(Sample) | |
| 待测样品 | - | 50μl | 50μl |
| NADP+/NADPH提取液 | 50μl | - | - |
| G6PDH工作液 | 100μl | 100μl | 100μl |
d. 37℃避光孵育10分钟。说明:此孵育步骤的目的是将样品中的NADP+转化为NADPH;在加入G6PDH工作液过程中须轻柔操作,以免产生气泡。若不慎出现气泡,可使用细小的吸头或针头戳破。
e. 适当混匀显色液,然后每孔加入10μl显色液,混匀,37℃避光孵育10-20分钟,此时会形成橙黄色的formazan。测量450nm处的吸光度。如果显色较浅,也可以适当延长孵育时间至30-60分钟,随着孵育时间延长,显色会逐渐加深。
4. 样品中NADP+/NADPH量的计算:
a. 计算标准品组中每个点的平均吸光度,减去空白对照组的吸光度,即为各个标准品的吸光度。
b. 以NADPH的浓度为横坐标,吸光度为纵坐标,绘制出标准曲线。NADPH标准品的检测效果请参考图2。如果孵育时间过长,高浓度标准品的显色会达到平台,此时宜选择未达到平台的标准品来绘制标准曲线,或者选择孵育时间较短的标准品吸光度数据来绘制标准曲线。

c. 根据标准曲线计算细胞、组织等样品中的NADP+和NADPH总浓度或者NADPH的浓度。未60℃加热处理时,计算得到的是样品中NADP+和NADPH总量的浓度(NADPtotal);60℃加热处理后,检测得到的是样品中NADPH的浓度。
备注:根据检测得到的浓度及样品的体积,即可计算出NADP+、NADPH、NADPtotal的量。
d. 根据如下计算公式,计算样品中NADP+的量以及NADP+/NADPH的比值。此时可以把NADP+和NADPH总量或各自的含量用单位细胞数量或单位组织重量中的含量来表示。
[NADP+] = [NADPtotal] - [NADPH]
[NADP+]/[NADPH] = ([NADPtotal] - [NADPH])/[NADPH]
e. 如果希望更加精确地来表述NADP+和NADPH总量或各自的含量,可以将样品用BCA法测定蛋白浓度。最终用单位蛋白量中NADP+和NADPH总量或各自的含量来比较精确地进行表述。
相关产品:
| 产品编号 | 产品名称 | 包装 |
| S0175 | NAD+/NADH检测试剂盒(WST-8法) | 100次 |
| S0176S | 增强型NAD+/NADH检测试剂盒(WST-8法) | 100次 |
| S0179 | NADP+/NADPH检测试剂盒(WST-8法) | 100次 |
| S0180S | 增强型NADP+/NADPH检测试剂盒(WST-8法) | 100次 |
| ST358 | NADH | 100mg |
| ST360 | NADPH | 10/50/200mg/1g |
| ST1110 | β-NADPH (≥97%, Reagent grade) | 5/25/100mg |
| ST2213 | β-NAD (≥98%, Reagent grade) | 250mg/1/5g |
| ST2218 | β-NADH (≥98%, Reagent grade) | 250mg/1/5g |
| ST2812 | β-NADP (≥98%, Reagent grade) | 50/250mg/1g |









 微信在线咨询
微信在线咨询